字體:小 中 大
字體:小 中 大 |
|
|
|
| 2021/05/28 15:39:31瀏覽5514|回應4|推薦29 | |
|
延伸閱讀;『FDA』緊急使用授權與完全核准差異在哪?輝瑞、Moderna力拼Covid-19疫苗的最後一哩路!
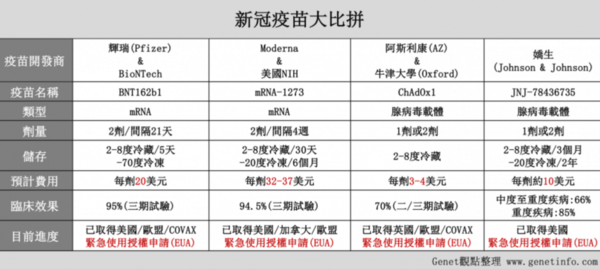
圖片來源:Genet觀點整理 全球都在企盼新冠肺炎疫苗盡快問世,國內已有三家廠商進入第一期臨床試驗。衛福部食藥署近日首度訂出緊急授權(EUA)條件,要求第二期人體臨床試驗人數須收案達3000人,且要追蹤一個月,且確認安全性和有效性後,才能上市量產。 吳明美強調,緊急授權主要是讓國內盡快有疫苗可用,各藥廠取得緊急使用授權(EUA)後可量產100萬劑疫苗,後續仍需同步做第三期臨床試驗,才能取得藥證繼續生產。至於第三期臨床試驗的收案人數,國外多為三、四萬人,國內則尚未定案,須視明年疫情狀況、廠商提交的實驗計畫進行通盤考量。 新聞引用至此~ 好了,現在大家知道高端跟聯亞打的算盤,就是要先拿到緊急授權EUA,來量產疫苗。但食藥署規定只能量產100萬劑,然後高端跟聯亞還是要同步做第三期人體試驗,三期通過才能拿到藥證繼續生產。而三期人體試驗必須做三萬人,觀察期6個月,三期達標後再6個月審查才能上市,此時才能叫做完全核准(Full Approval) 但是綠營卻大肆宣傳,BNT疫苗大陸沒核准,也沒有藥證,所以台灣不能跟上海復星買,一定要跟原廠買?綠營是想要告訴大家,BNT有德國或美國藥證嗎? 大家知道現在各國使用的BNT、莫德那、AZ跟嬌生疫苗,有哪一個有藥證嗎?答案是一個都沒有!所有這些疫苗,都在緊急授權使用的階段。而這些疫苗,都已經做完三期測試滿六個月,正在跟美國及歐盟申請藥證核准,後續還有漫長的審查。不過比起高端跟聯亞連二期都還沒通過是快多了! 美國FDA之所以在911後訂定EUA標準,就是要在國家有重大危難或疫情時,能快速將未核准但可能有效的醫療產品投入救人,雖然可以使用,但還是必須做第三期試驗,取得FDA的完全核准。這就是現在這些疫苗都沒有藥證,卻已經施打數億劑的原因了! 版主相信台灣的疫苗,目前並沒有外銷的計畫,所以恐怕也不會向美國FDA申請EUA,只要外國疫苗進不來或是不夠,高端跟聯亞有台灣食藥署的緊急授權EUA就能賣,至於只能生產100萬劑的規定,大家可以觀察看看會不會突然消失! 同樣沒藥證,BNT疫苗連買都不能買,但國產疫苗卻可以上市?這標準,也只有綠營掰得出來! |
|
| ( 時事評論|政治 ) |