字體:小 中 大
字體:小 中 大 |
|
|
|
| 2021/06/02 07:36:04瀏覽7602|回應6|推薦30 | |
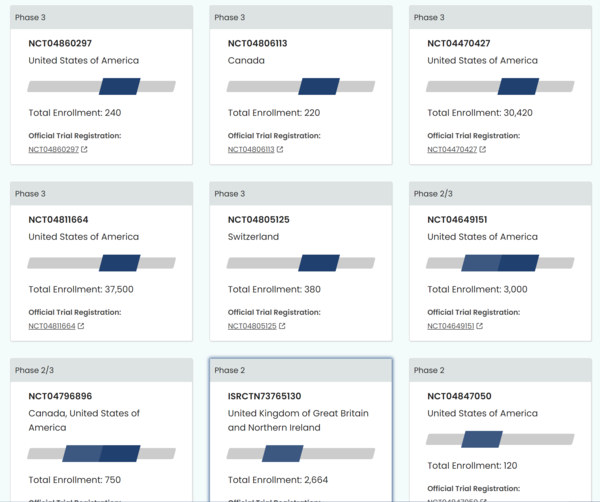
相信大家最近最常聽到的一個名詞就是緊急授權(Emergency Use Authorization, EUA﹚。民進黨現在上至總統下到網軍,不管是開記者會也好做哏圖也好,為了讓高端疫苗能不做三期就拿到緊急授權,不惜用假資料、假圖表、假數字來抹黑國外已經「做了三期、有中期報告、有最終報告、有證明有效性、經過美國FDA、歐盟及WHO認證」的現有疫苗,甚至還有人說棘蛋白重組的高端疫苗跟mRNA的莫德納疫苗兩種開發方式完全無相關的疫苗是攣生兄弟?台灣人真的那麼好騙? 美國在911事件之後創立了EUA制度,是為了在國家有緊急危難,或是有國家級傳染病快速流行的時候,能夠將醫療用品或是尚未拿到藥證的新藥投入使用,讓人民能盡快度過危機!雖然EUA開了方便之門,但是核准並不是毫無限制。美國FDA在今年的五月,也就是前幾天,發布了由生物評估及研究中心(Center for Biologics Evaluation and Research﹚制定的「預防新冠肺炎疫苗之緊急授權/產業指導原則」(Emergency Use Authorization for Vaccines to Prevent COVID-19/ Guidance for Industry﹚,其中就一再提到,雖然EUA是為了救急,但是如何確認疫苗的有效性,跟疫苗廠商需要做的人體試驗報告及結果評估,才是美國食藥署考慮核准緊急授權與否的重要考慮因素。就算疫情嚴重,需要疫苗救急,該做的人體試驗並不能跳過,尤其是第三期的人體試驗,各疫苗廠除了必須盡量放大受試人數,還必須在不同國家、不同人種跟不同年齡層的感染嚴重地區作大規模三期人體試驗,試驗方法更是必須有雙盲、隨機及普遍性原則,來確保試驗數據不會有偏差。 就以最近到貨台灣的莫德納疫苗來說,該疫苗光是三期試驗就在美國、加拿大及瑞士做了七次,試驗人數更是高達72,510人,更別說二期在美國、加拿大跟英國做了九次,試驗人數也達到8,664人了!
圖片來源:WHO網站 美國FDA除了要求受試人數必須足夠之外,更要求疫苗廠在申請EUA之前,必須提供至少做到「三期人體試驗中期報告」給FDA,才會開始審查。不僅如此,疫苗廠還必須繼續做最終報告並提供詳細數據給FDA,可不是申請送件就等著核准出貨了! 更重要的是緊急使用授權的精神,之所以要EUA,就是因為國家有急迫需要,且市場上並沒有現成的疫苗,或是尚未開發出來,才會緊急授權,就算拿到授權,藥廠也必須繼續將流程完成,花好幾年的時間拿到藥證,也就是FDA Full Approval,這個疫苗才算真正開發完成。不過拿到藥證之後,藥廠還會作第四期,也就是上市後的人體試驗,通過大量病人使用後的長期觀察確定療效及副作用。 現在大家對於緊急授權EUA應該已經有基本的理解了,那麼台灣的國產疫苗符合EUA的條件嗎?現在台灣的高端跟聯亞疫苗,除了沒有做三期,二期人數也不足,而且連二期解盲都還沒完成。這樣的條件,拿到美國FDA是不可能讓它申請EUA的。更何況,現在市面上已經有BNT、莫德納、AZ、嬌生、國藥等通過WHO認證的疫苗,昨天6月1日,大陸的科興疫苗也通過了WHO緊急授權認證,市場上有這麼多疫苗可以買,為何台灣食藥署要緊急授權給一個只做二期的疫苗呢? 說到這大家就應該知道,為什麼民進黨政府一直說謊,告訴人民都是大陸阻擋害我們買不到疫苗了吧?民間都有管道跟原廠買疫苗捐給政府,大陸也願意捐給台灣由德國原廠出貨的BNT疫苗,日本也有一堆不要的AZ疫苗考慮捐給台灣,別人都買得到,民間都買得到,結果只有民進黨政府買不到?是在騙誰呢? 民進黨卡國外疫苗,卻急著要給只做二期的國產疫苗緊急授權EUA,既沒有「緊急」的急迫性,更不是沒有其他成熟的外國疫苗可供「使用」,這樣的緊急使用授權,有什麼正當性呢? 沒有緊急性的緊急授權,就是濫權圖利廠商罷了! |
|
| ( 時事評論|政治 ) |