

 字體:小 中 大
字體:小 中 大 |
|
|
|
| 2014/09/30 09:10:30瀏覽13992|回應0|推薦6 | |
QUANT e-Sportlimousine 這輛性能堪比McLaren P1 的超級跑車,卻以不污染環境的鹽水為動力。這款概念車採「液流電池」使用了Flow Cell 流動電池技術,今年3月在日內瓦車展亮相後,日前更獲准在歐洲道路行駛。經道路測試後,生產前景看好。 由列支敦斯登「奈米液流電池」(NanoFlowcell)公司研發的QUANT e-Sportlimousine,車前有 2 個各 200 公升鹽水缸,啟動後,鹽水透過兩水缸中間薄膜交互流動,產生的電力透過液流電池儲存在超級電容器。水缸加滿水,一次可跑 400 至 600 公里。該公司宣稱,可儲存的電力,是同重量鋰電池 5 倍。 最高時速 380 公里。
如果電極與電解質溶液間沒有一個自發的氧化還原反應,在這種情況下,電解質就不會參與反應,此時負極(陽極)還是活潑金屬失電子(氧化反應),正極(陰極)就變成了 O2 得電子(還原反應)。例如銅和 NaCl 本身就不能反應,所以形成原電池時,NaCl 也不會參與反應,NaCl 就僅僅起一個導電的作用 。 如果電極與電解質溶液間存在一個自發的氧化還原反應(就是在一般條件下,未形成原電池時就能發生的氧化還原反應),在這種情況下,電解質就要參與反應,負極是活潑金屬失電子,正極是電解質的陽離子得電子。例如汽車的電瓶大部分是鉛酸蓄電池,電解液主要是硫酸,它的作用是和極板的鉛發生可逆化學反應,將化學能轉變為電能的。
當電池連接電路後,鋅電極 (陽極) 發生以下的氧化反應: Zn (s)-→ Zn2+ (aq) + 2 e- 銅電極 (陰極) 則發生以下的還原反應: Cu2+ (aq) + 2 e- → Cu (s) 因此整體的化學反應是 Zn (s) + Cu2+ (aq)-→ Zn2+ (aq) + Cu (s) 當電池運作時,鋅電極漸漸溶解,變成鋅離子,而銅離子則變成固態的銅,積聚在銅電極上,使電極變厚。硫酸鋅溶液中的鋅離子和銅電極上的銅並沒有參與化學反應。電池運作一段時間後,硫酸鋅溶液中的鋅離子濃度增加,而硫酸銅溶液中的銅離子濃度減少,使電流下降。同理乾電池也是類似運作原理,只是將電解液改成糊狀物而已。 至於常用於 3C 產品的鋰離子電池,是以金屬鋰作為負極材料,至於正極材料的選擇有很多,目前主流產品多採用鋰鐵磷酸鹽。電解液則採鋰鹽,如高氯酸鋰(LiClO4)、六氟磷酸鋰(LiPF6)、四氟硼酸鋰(LiBF4) 溶於有機溶劑,如乙醚、乙烯碳酸酯、丙烯碳酸酯、二乙基碳酸酯等製成。 所以目前,我們用的絕大部分電池都來自於一個古老的模型——公元1800年的原電池。只是近 300 年來,人們不斷尋找正極和負極材料,提升能量密度,但無論是乾電池、鎳鎘電池還是流行的鋰電池,都是材料的升級。原理和300 多年前的電池基本類似。只是這種電池對活性物質的利用率很低,能夠產生電能的物質被包裹在必須的非活性物質之中。這些非活性物質往往價格不菲,而且降低了活性物質的利用率。現在的電池中,50%的活性物質能被利用,效率就算不低了。 燃料電池
這種發電方式雖說不靠活性金屬,但是所使用鉑觸媒,卻佔電池組成本的四成。如何能將足夠的氫弄上車也是一個很大的問題,如果想達到消費者所要求的行車里程數。640 公里左右的路程,則需 5~7 公斤的氫,但是當今燃料電池原型車卻只能承載 2.5 ~ 3.5 公斤。 液流電池
估計 QUANT e-Sportlimousine 所使用的應該就是屬於這類的電池,但是液流電池的主要缺點是體積往往極為龐大,不適用於行動裝置或汽車使用,因此雖然發展的早,卻ㄧ直沒有開花結果。所以網上有人質疑 NanoFlowcell AG 公司公布的數據不真實,是在吹牛忽悠。因為 NanoFlowcell AG 公司要是真的做到這種水平的話,首先關注的不應該是汽車行業,而是軍事用途。這玩意要是裝到柴電潛艇裡面,戰斗力和水下巡航都會大增。 結語 從前一篇『空氣汽車』一文中可以知道,很多類似這種環保科技,目前來看總是噱頭大過於實際。但是透過科學家的努力,我相信總有達成目標的一天!只是這些媒體報導的時候可不可以先做點功課呢?比方說『920匹馬力超跑 加鹽水跑600公里』真的很容易讓人誤會這車只要加一般的鹽水就可以跑呢?如果真的是這樣,還要核電廠幹嘛? 解釋名詞 電解質 1、可以離解成帶電荷離子的物質,就是電解質。強電解質指在溶液中能完全離解的物質。無機酸或鹼屬於這一類,如鹽酸:HCl→H++Cl-。弱電解質指在溶液中能部分離解的物質。有機酸或鹼屬於這一類。如碳酸溶液中有未經離解的碳酸分子、氫離子及碳酸氫根離子三者同時並存。 2、 一種物質本身帶有電荷以離子形式存在。當溶液兩側接通直流電,該物質將被電解產生性質不同的另一物質,這種物質稱為電解質。如機體內Na+、K+、Cl-、HCO3-、Mg++、Ca++等。它們起著調節體液酸鹼平衡,滲透壓等各種功能。 3、在水溶液中或在熔融狀態下能導電的化合物,如酸類、鹼類及鹽類等。電解質由於能電離成離子,故能導電。電離度大的稱強電解質,電離度小的稱弱電解質(見電離度)。電解質的水溶液叫電解質溶液。海水就是一個天然的電解質溶液 4、化學元素上把溶解於水後能導電的物質稱為電解質,如氯化鈉、鹽酸、氯化鋅、硫酸鈉等等.把溶解於水後不能導電的物質稱為非電解質,如葡萄搪、酒精、醋酸等等.電解質能夠導電是因為電解質中含有能自由流動的帶點物體 不同的電池電解液密度不一樣,像汽車電瓶應該加密度是1.28的硫酸,電動車電瓶密度是1.33的硫酸。 如果電池當中的酸濃度過高,會導致一下幾個現象產生。 1.電池比較有勁,跑的稍微遠一些。 2.電池靜止電壓高,放電平台高。 3.充電不容易充滿,容易硫化。 4.電池壞的快,用不久。 綜合來講,不要對電池裡加濃度高的酸,那樣弊大於利! 參考連結
鹽水也能當燃料燒!? |
|
| ( 知識學習|科學百科 ) |



 ㄧ則新聞
ㄧ則新聞  看完新聞後感覺非常新鮮,如果按照能量守恆定律,如果鹽水中沒有用某種方式注入能量,又或內含化學能?基本上我並不相信可以產生電流!?所以我上網查了一下似乎目前沒有一項技術可以單純用鹽水發電的。比方說傳統的伏打電池利用正負極不同的金屬釋放電子能力(活性)不同來產生所謂的電位差,而此時電池電解液所扮演的角色除了負責傳遞電子外,還扮演電極物質掙脫到溶液中的工作,從而保證電壓的穩定。
看完新聞後感覺非常新鮮,如果按照能量守恆定律,如果鹽水中沒有用某種方式注入能量,又或內含化學能?基本上我並不相信可以產生電流!?所以我上網查了一下似乎目前沒有一項技術可以單純用鹽水發電的。比方說傳統的伏打電池利用正負極不同的金屬釋放電子能力(活性)不同來產生所謂的電位差,而此時電池電解液所扮演的角色除了負責傳遞電子外,還扮演電極物質掙脫到溶液中的工作,從而保證電壓的穩定。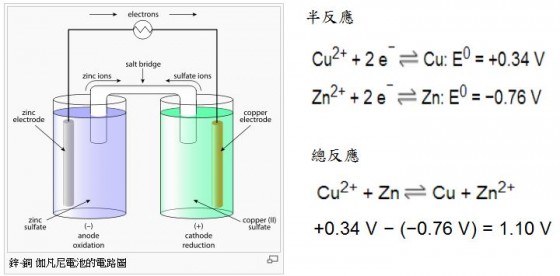 具體我們以伽伐尼電池來說明,伽伐尼電池可分為兩部份,由滲水的薄膜或鹽橋相連。薄膜或鹽橋容許硫酸離子從一邊流動到另一邊,平衡電荷,但同時可使兩邊的銅離子和鋅離子分開。
具體我們以伽伐尼電池來說明,伽伐尼電池可分為兩部份,由滲水的薄膜或鹽橋相連。薄膜或鹽橋容許硫酸離子從一邊流動到另一邊,平衡電荷,但同時可使兩邊的銅離子和鋅離子分開。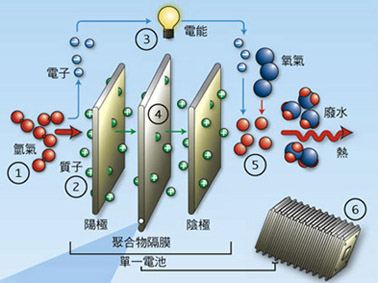 燃料電池的運作方式與電瓶相似。只要持續供給氫氣( 或天然氣)與氧氣,燃料電池就能一直發電。左圖為質子交換膜(PEM)燃料電池之示意圖,由兩片薄的多孔電極構成陽極與陰極,兩極之間以固態聚合物隔膜電解質隔離。每片電極的其中一面鍍有觸媒,以鉑為主成份。氫原子進入電池後,經陽極觸媒分解為電子與質子。電子沿著外部電路流動,供電給驅動馬達。質子同時透過隔膜抵達陰極。陰極側的觸媒則將質子及回流的電子,與空氣中的氧結合而生成水與熱。欲提高電壓,則將多組電池集結成電池組即可。
燃料電池的運作方式與電瓶相似。只要持續供給氫氣( 或天然氣)與氧氣,燃料電池就能一直發電。左圖為質子交換膜(PEM)燃料電池之示意圖,由兩片薄的多孔電極構成陽極與陰極,兩極之間以固態聚合物隔膜電解質隔離。每片電極的其中一面鍍有觸媒,以鉑為主成份。氫原子進入電池後,經陽極觸媒分解為電子與質子。電子沿著外部電路流動,供電給驅動馬達。質子同時透過隔膜抵達陰極。陰極側的觸媒則將質子及回流的電子,與空氣中的氧結合而生成水與熱。欲提高電壓,則將多組電池集結成電池組即可。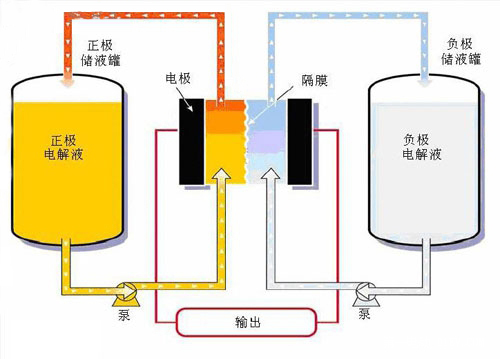 另外一種不靠活性金屬來發電的電池,稱之為電化學液流電池(electrochemical flow cell)一般稱為氧化還原液流電池(flow redox cell 或者 redox flow cell)是一種新型的大型電化學儲能裝置,正負極如果全使用釩鹽溶液的則稱之為全釩液流電池,簡稱釩電池 .其荷電狀態 100% 時電池的開路電壓可達 1.5 V.。在這個系統中,通常包含兩個容器,其中儲存著液體化學溶劑,形成兩個次系統。這兩個次系統間的連接部份,為發電區,以一個薄膜隔開。這兩種化學溶劑,由它們所在容器,流動到發電區,隔著薄膜,產生離子交換,透過這種方式來進行放電或儲電。
另外一種不靠活性金屬來發電的電池,稱之為電化學液流電池(electrochemical flow cell)一般稱為氧化還原液流電池(flow redox cell 或者 redox flow cell)是一種新型的大型電化學儲能裝置,正負極如果全使用釩鹽溶液的則稱之為全釩液流電池,簡稱釩電池 .其荷電狀態 100% 時電池的開路電壓可達 1.5 V.。在這個系統中,通常包含兩個容器,其中儲存著液體化學溶劑,形成兩個次系統。這兩個次系統間的連接部份,為發電區,以一個薄膜隔開。這兩種化學溶劑,由它們所在容器,流動到發電區,隔著薄膜,產生離子交換,透過這種方式來進行放電或儲電。









