字體:小 中 大
字體:小 中 大 |
|
|
|
| 2023/04/11 15:45:57瀏覽1557|回應0|推薦0 | |
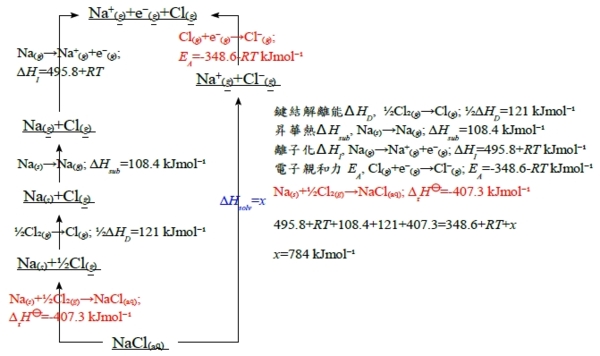
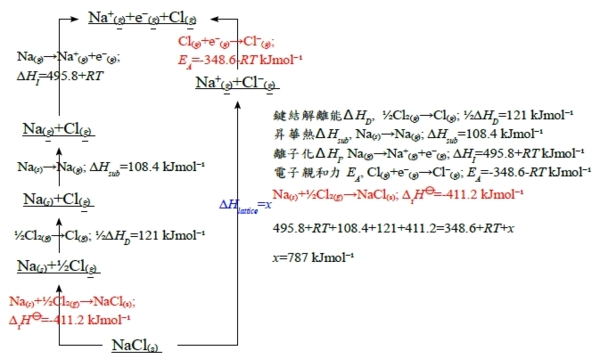
化學反應熱, q,是路徑函數,取決於反應過程;但用狀態函數討論能量變化比較方便,特別是與反應是否發生無關 反應焓: ∆U=qᵥ if no work and constant V; ∆H=qₚ if no other work than pV work &costant p ∆H>0 吸熱反應會造成溫度下降(在絕熱條件下) ∆H<0 span="">放熱反應會造成溫度上升(在絕熱條件下) 標準焓變化量∆rH⦵ (p.s. ∆rHª at 1 atm) 標準狀態: 純物質在1bar和特定溫度下的狀態, i.e. 1 bar=10⁵Pa, 特定溫度=25℃, ₮ s for solid, l for liquid, and g for gas. ex. H₂O₍ₗ₎ liquid water C₍ₛ, graphite₎+O₂₍g₎→CO₂₍g₎ ∆rH⦵(₮)=-393.5 kJmol⁻¹ 化學反應式中均是未混合的反應物與產物;溶液中的離子反應除外,混不混合差別不大 生成反應熱, ∆fH⦵ 元素的生成熱=0 at all temperatures. Hesss law和反應焓 ex. 2NH₃₍ₗ₎+2NO₍g₎→H₂O₂₍ₗ₎+4N₂₍g₎ at ₮, ∆rH⦵=(-187.8+40)-(2264+290.25)=-896.3 kJmol⁻¹ 一般的計算: aA+bB→cC+dD, 質量守恆 0=cC+dD-aA-bB or 0=∑JvJJ, vJ:化學反應中平衡係數 ∆rH⦵=(c∆fHC⦵+d∆fHD⦵)-(a∆fHA⦵+b∆fHB⦵) or ∆rH⦵=∑JvJ∆fHJ⦵, ∆fHJ⦵:J物質標準生成反應熱 Hesss law: 若一反應為二個反應式的代數和時,其反應熱為此二反應熱的代數和。在條件不變的情況下,化學反應的反應熱只與起始和終了狀態有關,與變化途徑無關 ex. 已知CH₂=CHCH₃₍g₎+H₂₍g₎→CH₃CH₂CH₃₍g₎ ∆rH⦵=-124 kJmol⁻¹, CH₃CH₂CH₃₍g₎+5O₂₍g₎→3CO₂₍g₎+4H₂O₍ₗ₎ ∆rH⦵=-2220 kJmol⁻¹, 求丙烯的燃燒熱? 丙烯的燃燒反應: C₃H₆₍g₎+⁹/₂O₂₍g₎→3CO₂₍g₎+3H₂O₍ₗ₎ ∆rH⦵=? C₃H₆₍g₎+H₂₍g₎→C₃H₈₍g₎ ∆rH⦵=-124 kJmol⁻¹, + C₃H₈₍g₎+5O₂₍g₎→3CO₂₍g₎+4H₂O₍ₗ₎ ∆rH⦵=-2220 kJmol⁻¹, + H₂O₍ₗ₎→H₂₍g₎+½O₂₍g₎ ∆rH⦵=+286 kJmol⁻¹ = C₃H₆₍g₎+⁹/₂O₂₍g₎→3CO₂₍g₎+3H₂O₍ₗ₎ ∆rH⦵=-2058 kJmol⁻¹ 反應焓的溫度關係: 許多反應都不是在25℃ (₮)發生,如何估計在不同溫度的反應焓 因為Cₚ=(∂H/∂T)ₚ→H(T₂)=H(T₁)+(T₂-T₁)(∂H/∂T)ₚ=H(T₁)+(T₂-T₁)Cₚ if temp. change from T₁ toT₂ . 假設Cₚ與溫度無關,上面的式子可用在化學反應中每個物質,所以∆rH⦵可改寫成 ∆rH(T₂)=∆rH(T₁)+(T₂-T₁)(Cₚ,products-Cₚ,reactants) 簡化為∆rH(T₂)=∆rH(T₁)+δT∆rCₚ 更正規的方式(避免假設Cₚ與溫度無關), dH=CₚdT, ∫dH=H(T₂)-H(T₁)=∫T₁T₂Cₚ(T)dT, 同樣地應用於化學反應中每個物質J, ∆rH(T₂)=∆rH(T₁)+∫T₁T₂∆rCₚ(T)dT Kirchhoffs law i.e. ∆rCₚ(T)=(cCₚ,C+dCₚ,D)-(aCₚ,A+bCₚ,B) in aA+bB→cC+dD, ∆rCₚ=∑JvJCₚ,J 通常莫耳比熱的數學式: Cₚ,J(T)=aJ+bJT+cJ/T², a,b,c與溫度無關 ∆rH與∆rU的關係: ∆rH=∆rU+(pV)products-(pV)reactants 若反應中只有固體和液體,反應前後體積大約相同, ∆rH=∆rU 反應中有氣體的話,假設都是理想氣體,pV項可以nRT取代: ∆rH=∆rU+∆vgasRT e.g. ∆vgas=+1 in H₂O₍ₗ₎→H₂O₍g₎, ∆vgas: 反應中氣體莫耳數變化 ex. estimate ∆rU⦵(₮) fo r ammonia from ∆fH⦵(₮) ³/₂H₂₍g₎+½N₂₍g₎→NH₃₍g₎, ∆vgas=1-½-³/₂=-1 and at ₮, RT=2.48 kJmol⁻¹ ∆rU⦵(₮)=∆fH⦵(₮)-∆vgasRT=-46.1-(-1)2.48=-43.6 kJmol⁻¹ 焓的種類 (i)燃燒焓, ∆cH, e.g. (C,H,O,N)compounds+O₂₍g₎→CO₂₍g₎+H₂O₍ₗ₎+N₂₍g₎ ex. 葡萄糖燃燒, C₆H₁₂O₆₍ₛ₎+6O₂₍g₎→6CO₂₍g₎+6H₂O₍ₗ₎; ∆cH⦵=-2808 kJmol⁻¹ 此放熱反應是細胞活動的基礎(aerobic respiration有氧呼吸); 有些微生物的細胞反應效率較低,如厭氧發酵的糖酵解glycolysis, C₆H₁₂O₆₍ₛ₎→enzymes→2CH₃CH(OH)COOH₍ₛ₎; ∆rH⦵=-120 kJmol⁻¹, 然後乳酸燃燒,CH₃CH(OH)COOH₍ₛ₎+3O₂₍g₎→3CO₂₍g₎+3H₂O₍ₗ₎; ∆cH⦵=-1344 kJmol⁻¹ (ii) 生成焓, ∆fH, 化合物生成焓是以元素被拆開成原子再組成化合物的過程來考慮,其中包含鍵結解離能∆HD, e.g. ∆H(A-B), the reaction enthalpy for AB₍g₎→A₍g₎+B₍g₎. 但須注意特定鍵結的解離能視分子其餘的結構而定, 如水的O-H鍵, ∆H⦵(HO-H)=492 vs. ∆H⦵(O-H)=428 kJmol⁻¹ 鍵結解離能分為兩種: 1. bond dissociation energy, D(A-B),在零度發生解離的內能變化量 2. bond enthalpy, E(A-B), 一系列有關的化合物平均得到的A-B鍵解離能, 例如∆H⦵(HO-H)和 ∆H⦵(O-H)的均值463 kJmol⁻¹ (iii)原子化焓, ∆aH,譬如水的∆aH應該是HO-H 和O-H解離能的和,920 kJmol⁻¹; 對金屬而言∆aH 也是昇華熱, M₍ₛ₎→M₍g₎, e.g. ∆aH(carbon)=716.68 kJmol⁻¹特別難測量 ex. 估計液態甲醇的生成焓, C₍ₛ₎+2H₂₍g₎+½O₂₍g₎→CH₃OH₍ₗ₎; 利用∆aH和bond enthalpy的數據 1. ∆aH⦵(C)+2∆H(H-H)+½∆H(O=O)=717+2436+½ 497=1838 kJmol⁻¹ 2. ∆Hₘ⦵=-[3E(C-H)+E(C-O)+E(O-H)]=-(3413+360+463)=-2062 kJmol⁻¹ 1+2, ∆fHₘ=-224 kJmol⁻¹, 又凝結熱=-37.99 kJmol⁻¹, 液態甲醇的總生成焓,∆fHₘ⦵=-262 kJmol⁻¹(測量值-239) ex. 2C₍ₛ₎+3H₂₍g₎+½O₂₍g₎→C₂H₅OH₍ₗ₎, 1. 2∆aH⦵(C)+3∆H(H-H)+½∆H(O=O)=2990.5, 2. -[5E(C-H)+E(C-C)+E(C-O)+E(O-H)]=-3236, 1+2=-245.5, and 凝結熱=-43.5 →∆fHₑ⦵=-289 kJmol⁻¹ (iv)昇華熱∆Hsub是相轉變焓的一個特例,蒸發熱∆Hvap,熔解熱∆Hmelt也稱潛熱都屬之, ex. 水蒸發 H₂O₍ₗ₎→H₂O₍g₎; ∆H⦵vap,m(₮)=+44.02, vs. +40.66 kJmol⁻¹ at 100℃. at 100℃, ∆Uvap=∆Hvap-∆vgasRT=40.66-3.1=37.56 kJmol⁻¹, 8% difference b/t ∆Hvap & ∆Uvap (v)氫化焓: 乙烯與苯的氫化, CH₂=CH₂₍g₎+H₂₍g₎→CH₃CH₃₍g₎ ∆rH⦵=-137 kJmol⁻¹, C₆H₆₍ₗ₎+H₂₍g₎→C₆H₁₂₍ₗ₎ ∆rH⦵=-205 kJmol⁻¹; 苯有3個碳雙鍵,反應熱應該是乙烯的3倍,為何只有-205? (vi)溶液中離子的解離熱,∆Hsoln,此焓假設無限稀薄溶液和離子間沒有作用的條件下;最常見的是水溶液aqueous solution, 例如: HCl₍g₎→HCl₍ₐq₎; ∆H⦵soln,m(₮)=-74.85 kJmol⁻¹,當鹽酸溶液比較濃時,生熱也會不同 根據Hess;s law,可得鹽酸溶液的生成熱: ½H₂₍g₎+½Cl₂₍g₎→HCl₍g₎; ∆rH⦵=-92.31 kJmol⁻¹,前後兩式相加即得 ½H₂₍g₎+½Cl₂₍g₎→HCl₍ₐq₎; ∆rH⦵=-167.16 kJmol⁻¹ 另一途徑可以將組成離子的解離熱相加; ½H₂₍g₎→H⁺₍ₐq₎; ∆rH⦵=0 kJmol⁻¹, ½Cl₂₍g₎→Cl⁻₍ₐq₎; ∆rH⦵=-167.2 kJmol⁻¹ e.g. define ½H₂₍g₎→H⁺₍ₐq₎; ∆rH⦵=0 by convention. → ½H₂₍g₎+½Cl₂₍g₎→H⁺₍ₐq₎+Cl⁻₍ₐq₎; ∆rH⦵=-167.2 kJmol⁻¹, i.e. H⁺₍ₐq₎+Cl⁻₍ₐq₎=HCl₍ₐq₎ ex. a. 求Na₍ₛ₎+½Cl₂₍g₎→NaCl₍ₐq₎的生成熱 Na₍ₛ₎→Na⁺₍ₐq₎; ∆rH⦵=-240.1 kJmol⁻¹, ½Cl₂₍g₎→Cl⁻₍ₐq₎; ∆rH⦵=-167.2 kJmol⁻¹相加 Na₍ₛ₎+½Cl₂₍g₎→NaCl₍ₐq₎; ∆rH⦵=-407.3 kJmol⁻¹ b. 求鹽的溶解熱, ∆Hsolv,可以用Born-Haber cycle分步驟來解
|
|
| ( 知識學習|科學百科 ) |