字體:小 中 大
字體:小 中 大 |
|
|
|
| 2021/09/29 21:47:32瀏覽1235|回應1|推薦29 | |
國外開發治療新冠口服用藥已經要進入臨床三期試驗,國產也有宣稱二期臨床達標(但不是「清冠一號」的中藥處方),預防與治療並行,才有可能達成所謂的與病毒共存。新的醫藥消息令人振奮,大家一起加油唄..... 就在這個萊豬症腐強力否認3+11破口、連神都騙的那個AABB聲嘶力竭的用幾十秒吼完區區幾十個字的施政報告之際,請容俺再那麼稍微提問一下: 那個迅速成功治癒非洲友邦元首的臺灣神藥倒底是啥? 就看這個症腐會不會再次利用這類後續治療用藥物的進程謀求各種OOXX..... 引用新聞 : 新冠口服藥 大廠搶開發 新冠口服藥 大廠搶開發2021-09-25 00:34 經濟日報 / 編譯陳家齊/綜合外電
雖然新冠肺炎疫苗降低了新冠肺炎疫情所造成的重症與致死率,但隨著各國都正準備新冠病毒(SARS-CoV-2)長期共存,輝瑞、默沙東、羅氏、鹽野義等大藥廠正積極開發更廉價、更能普及的抗病毒口服藥。 美聯社 雖然新冠肺炎疫苗降低了新冠肺炎疫情所造成的重症與致死率,但隨著各國都正準備新冠病毒(SARS-CoV-2)長期共存,輝瑞、默沙東、羅氏、鹽野義等大藥廠正積極開發更廉價、更能普及的抗病毒口服藥,希望在治療未來病患的同時,找到疫情大流行後的新商機。 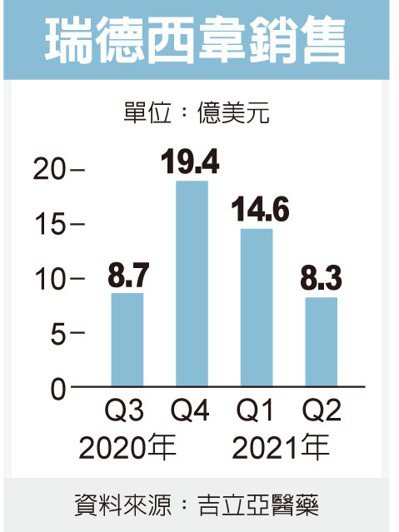
美國默沙東藥廠正與新創公司Ridgeback合作,開發名為「Molnupiravir」的口服抗病毒藥,目前已在日本、台灣等地進行第三期臨床試驗,測試結果可能最快10月就會出爐。Molnupiravir原本是開發來治療流感,但也應會對新冠肺炎有療效,用來及早治療輕度與中度病患。美國政府已簽約以12億美元購買170萬劑,而默沙東計畫年底之前就量產1,000萬劑。 輝瑞正在開發兩種抗病毒藥,一種是口服,一種是靜脈注射,是根據之前SARS疫情的研究結果而開發。這些藥也是針對尚未住院的輕症患者,試驗結果預計在10月到12月期間可以發表,可能最快明年就能上市。 羅氏則與Atea公司合作,對住院的重症患者開發藥物,可能在明年可以供應全球。日本的鹽野義製藥也在今年7月對其口服藥物展開第一期試驗,希望能在明年底之前推出。 目前市面上唯一的新冠肺炎抗病毒藥物是瑞德西韋(Remdesivir),這款由吉立亞醫藥公司開發、主要使用在重症病人的藥物非常昂貴,每劑要價2,100美元,如果各藥廠能開發出較便宜,就像克流感一樣方便使用的口服藥物,可望為阻擋疫情貢獻更多力量。 瑞德西韋今年第2季的銷售額就高達8.29億美元,自新冠疫情爆發以來已經超過50億美元。治療輕症的口服抗病毒藥商機,可能比瑞德西韋還要驚人。
引用新聞 : 新冠口服藥來了?這款「最後臨床試驗」 在家就能用 新冠口服藥來了?這款「最後臨床試驗」 在家就能用發佈時間:2021/09/28 23:53 最後更新時間:2021/09/28 23:53
日本塩野義製藥公司研發新冠口服藥有新進展。(示意圖/shutterstock 達志影像) 日本塩野義製藥公司今天宣布,他們正在研發供COVID-19(2019冠狀病毒疾病)輕症患者口服的治療藥物,已進入最後階段的臨床試驗。 日本朝日新聞報導,塩野義製藥從7月開始初期臨床試驗,結果在安全性方面似乎沒有太大問題。口服新藥主要是供COVID-19輕症患者使用,優點是在家就能服用。 在初期臨床試驗中,主要是讓健康成人服用藥物來確認安全性;由於服用後血液內成分濃度高於目標值,讓藥廠方面認為「可以期待有效性」。 最後階段的臨床試驗以日本境內輕症及無症狀的患者為對象實施,將在關注有效性的同時,準備向日本政府申請批准新藥。 藥廠預想新藥可以抑制病毒增生,能預防重症化及改善發燒、咳嗽等症狀。 日本政府目前僅批准供輕症患者使用的點滴治療藥,讓外界對口服藥的誕生抱持很大期待。 日本放送協會(NHK)報導,塩野義製藥是在本月27日進入下一階段的臨床試驗,將透過每天一次、連續5天投藥,來確認口服藥的有效性與安全性。 這次參與臨床試驗的對象不僅是住院患者,也包括在住宿設施療養的患者。 塩野義製藥暫未說明臨床試驗的規模及預計結束的時間,但目前已知將在今年內做好可供給100萬人份的生產體制。 (中央社) 引用新聞 : 台灣第一 生華科新冠口服藥二期臨床數據達標 台灣第一 生華科新冠口服藥二期臨床數據達標文|王筱君 攝影|高迪
生華科開發中新藥Silmitasertib療效數據已展現對中症患者的臨床效益(Clinical benefit),是目前台灣開發新冠藥物生技公司中,第一家新藥在抗COVID-19治療已經取得正向人體療效數據。(生華科提供) 華科(6492)今日公告開發中抗新冠藥物Silmitasertib(CX-4945)治療中症患者二期臨床試驗初步數據分析成果,具統計上顯著差異(Statistically significance)和臨床上意義(Clinical meaningful),生華科Silmitasertib顯著加速患者達到臨床定義上的康復(Clinical Recovery),且接受Silmitasertib治療患者並無任何嚴重不良事件(SAE),Silmitasertib展現高度安全性且耐受性良好。 生華科總經理宋台生表示,Silmitasertib的療效數據已展現對中症患者的臨床效益(Clinical benefit),是目前台灣開發新冠藥物生技公司中,第一家新藥在抗COVID-19治療已經取得正向人體療效數據,且Silmitasertib是口服劑型,方便新冠確診患者在家使用。 這項新冠肺炎二期人體臨床試驗為開放性、隨機之雙臂設計,試驗在美國兩個收案中心共招募20位在參加試驗前7日內確診,症狀為中度的門診新冠確診患者,以1:1方別納入試驗組和對照組,進入試驗組的患者以口服方式,接受共14天Silmitasertib的完整療程,並以標準療法或支持性療法為對照組。此試驗中,進入試驗組的患者僅接受Silmitasertib的治療,並無合併使用其他新冠藥物。 生華科是台灣第一家通過新冠肺炎二期臨床的新藥公司,圖為團隊董事長胡定吾(左)與總經理宋台生(右)。 此項IIT試驗符合FDA嚴格的監管標準,臨床數據及成果皆屬於生華科所有,臨床數據將用於未來申請藥證,同時希望加速相關藥廠授權或合作進行。關於Silmitasertib的臨床數據摘要,已獲2021年國際流感和其他呼吸道病毒學會(ISIRV)及世界衛生組織(WHO)主辦抗COVID-19大會的接受,並將於10月19至21日大會期間公開發表。 國際流感和其他呼吸道病毒疾病學會 (ISIRV)是第一個專注在全球重大公共衛生領域、獨立且具權威性的國際科學專業學會,成立宗旨在促進流感和其他呼吸道病毒疾病的預防、監測、治療和控制。 此次大會由ISIRV和WHO共同主辦,將針對COVID-19、流感、其他呼吸道病毒的演變、流行病學和影響進行討論,更重要的是將邀集相關領域的科學家和專業人士發表疫苗、抗病毒藥物等最具開發潛力和最新臨床進程的數據發表,希望透過這個平台的交流,加速創新療法的開發和國際合作。 面對新冠病毒不斷變異,藥物治療策略必需藉由靶向宿主細胞的蛋白酶,阻斷病毒複製及感染;而CK2為美國加州大學舊金山分校定量生物學研究所(UCSF-QBI)科學團隊研究發現,新冠病毒SARS-COV-2在細胞中複製所需要之最關鍵且不可或缺的蛋白酶。 生華科將繼續驗證Silmitasertib藉由抑制宿主細胞CK2,達到抗感染及抗發炎降低免疫風暴的雙重機制,憑藉其靶向宿主細胞CK2不受變種病毒影響療效,及更便利使用、經濟的口服劑型優勢,早日開發成功。 更新時間|2021.09.27 01:44
引用衛福部公告 : 衛生福利部核准「臺灣清冠一號濃縮製劑」專案製造,應經中醫師處方,民眾勿自行購買服用 衛生福利部核准「臺灣清冠一號濃縮製劑」專案製造,應經中醫師處方,民眾勿自行購買服用資料來源:中醫藥司 建檔日期:110-05-19 更新時間:110-05-19 因應新冠肺炎疫情需要,衛生福利部同意已取得「臺灣清冠一號濃縮製劑」外銷專用藥品許可證之藥廠,得依藥事法第48條之2規定,向衛生福利部申請專案製造。昨天並已核准第1家藥廠「臺灣清冠一號濃縮製劑」專案製造,目前並積極審查其他藥廠專案製造申請案。該藥品類別為「須由中醫師處方使用」,核准製造期間至中央流行疫情指揮中心解散日止。民眾應由中醫師診斷臨床症狀後,給予「臺灣清冠一號濃縮製劑」專案藥品,確診者切勿自行到中醫診所求診用藥,以免造成社區感染擴大。 「臺灣清冠一號濃縮製劑」處方組成為黃芩、魚腥草、北板藍根、栝樓實、荊芥、薄荷、桑葉、厚朴、炙甘草及防風等10種中藥材,與衛福部110年4月12日函頒「新型冠狀病毒病(新冠肺炎)中醫會診分期治療指引」之輕症方相同,可用於治療新冠肺炎無症狀帶原與初發作症狀者,非預防保健使用。 為因應疫情升溫,民眾應避免不必要移動、活動或集會,若有至中醫診所看診之需求,可依健保署所提「因應COVID-19之視訊診療調整作為」方案進行,屬居家隔離、居家檢疫或自主健康管理者,由衛生局轉介至指定視訊診療之醫療機構,安排看診;若非屬前開三類人員,可撥打指定之視訊診療醫療機構視訊診療門診掛號專線,或上網至指定之視訊診療醫療機構網頁掛號,約定診療時間。民眾不可自行至中藥房、網路及其他通路購買來路不明宣稱清冠一號之中藥方,以免誤服不明藥物導致傷害。 至於中醫醫療院所應遵照中央流行疫情指揮中心公告「醫療照護機構感染管制相關指引」進行相關防疫措施,以保障看診民眾及醫護人員之安全。 衛生福利部呼籲所有防疫工作,包括篩檢、通報與醫療均依照中央流行疫情指揮中心的指示執行,現在是國內防疫的重要時刻,請民眾配合做好各項防疫措施及個人防護工作,共同守住防疫陣線。 |
|
| ( 時事評論|公共議題 ) |