字體:小 中 大
字體:小 中 大 |
|
|
|
| 2017/01/17 11:20:44瀏覽36494|回應0|推薦23 | |
最近在看書,看到關於飽和蒸氣壓的內容。 想當初高中化學沒好好念,一直沒搞懂飽和蒸氣的物理意義是什麼,現在可好了,看吧,書到用時方恨少,於是我只好乖乖地上網啃資料。 結果看了一晚上的網頁這才驚覺,原來課本上講的、大家所理解的,就和當初我囫圇吞棗的記憶沒什麼兩樣呀!什麼道爾頓、理想氣體分程式、亞佛加厥假說、同溫同體積的理想氣體分子數量相同,我甚至還記得 1 mole 有 6×1023個分子啊!是,沒錯,我是不會解題,但我記得的概念一樣沒少啊。 但重點不在於我知道什麼,而是我到底理解了什麼。我知道水的飽和蒸氣壓等於大氣壓時,水會沸騰;但我更想理解的是,為什麼水的飽和蒸氣壓等於大氣在時水會沸騰! 不是說網路上的文章沒有解釋,而是這些解釋太膚淺,一堆話繞了半天也就是「水的飽和蒸氣壓等於大氣在時水會沸騰」這句話的改寫,再不然就是一堆看似有理的理論,但講到後來卻又互相矛盾的文章。 所以,到後來我覺得,不是我高中沒學好,而是我想知道的東西沒教,因為,天殺的,你知道水會沸騰就好了,我已經告訴你這時飽和蒸氣壓等於大氣壓了,你還想怎樣?啊? 嗯,諸如此類,你知道的。 事到如此,只好靠自己了。 以下是我自己琢磨出來的,文長,想知道為什麼水在飽和蒸氣壓等於大氣壓時會沸騰但又沒耐心的人,可以拉到最下面,那兒有重點整理。 本文開始! 首先,在探討飽和蒸氣壓之前,先來看看氣體的壓力如何產生:
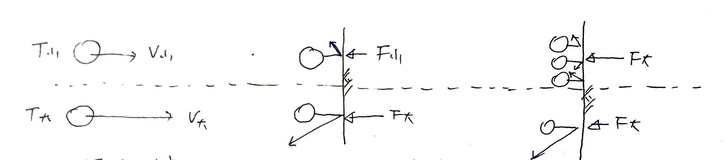
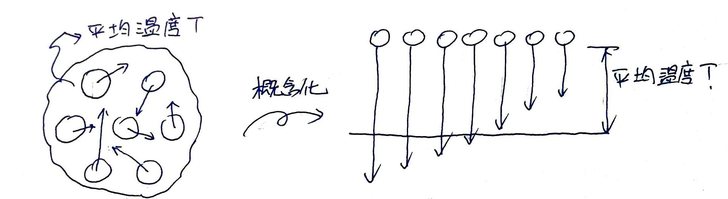
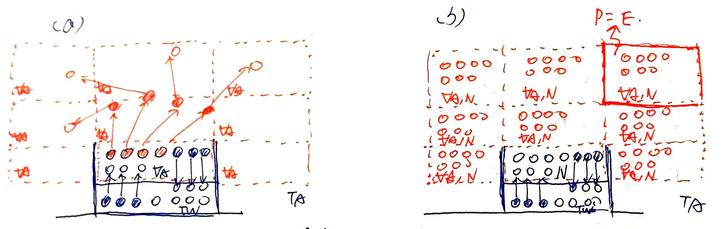
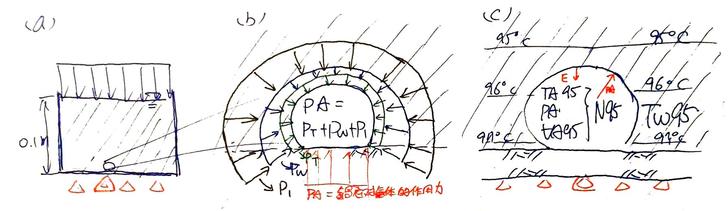
Fig 1. 密閉空間中,溫度T對 (a) 分子速度V與 (b) 施力F之影響,及(c)分子數量n對施F力之影響。 (a) T給予分子速度。 (b) 分子運動狀態改變(速度變化),起因為受力,施力來源為壁面。 (c) 要增加壁面受力,可增加撞壁的分子數量。 氣體的溫度T,來自其分子的運動速度V;即氣體中分子們的運動度速越大,則氣體的溫度越高(圖1.a)(這就是大氣增溫層的氣溫可以到四、五十度的關係吧)。 當氣體分子撞到壁面後(圖1.b),分子反彈而出現運動狀態的改變,這個改變來自於壁面的施力-F(定義向右為正)。壁面施給分子的力-F,其反作用力即為分子施給壁面的力+F,這個力施加在單位面積A上,即為該面積的壓強P。 (題外話,「壓強」在中文中更常叫作「壓力」,但壓力不是「力」,而是「單位面積的受力」;英文叫做pressure,也不是force。所以有人把pressure翻作「壓強」,個人覺得比壓力貼切多了) 。 要如何增加壁面單位面積上的受力(即壓強)P呢?從圖1.c中的上半部可看出,只要增加空間中的分子數量,則撞在壁面上的分子數量便會跟著增加,此時即便氣體分子速度V低(因溫度T低),但因同時有較多的分子在壁面上施力,壓強仍可以獲得提升,使其與圖1.c中下半部的壁面受力相同。 綜合上述,可知決定分子運動速度V的,不是壓強P(即壓力),而是溫度T,而壓強P僅是分子運動速度發生改變時(撞牆或水面)的副作用而已。 再來,一團溫度為T的氣體,當中的每個分子都具有不同的運動方向與速率(圖2.a),如果將其概念化,其結果則如圖2.b所示。
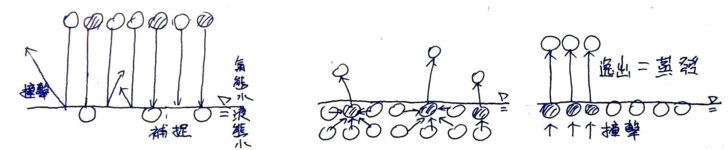
Fig2. 平均溫度為T的氣體團中,分子們的運動狀態。(a) 實際,(b) 概念化。 (題外話,這樣的概念化是有憑有據的,課本上說了,分子的運動速度V決定了溫度T,或是反過來亦可,但一團溫度為T的氣體,其每個分子的溫度Tm都一樣嗎?顯然不是。一團氣體中,分子速度有快有慢,如圖2.a所示。如果把實際的氣體分子運態狀態概念化,也就是讓分子們依速度V排排站好,其結果如圖2.b所示,此時可看出,在所有的分子中,有一部份的分子速度比平均值大,另一部份比平均值小,但平均起來就是平均速度V(廢話)。然而,前述說氣體分子的運動速度即可表示為溫度,因此圖2中,那團氣體的平均溫度T,即可用分子們的平均速度V來表示。也就是說,在一團平均溫度為T的氣體中,有一部份的分子運動速度比整體的平均速度V小,另一部份則比平均速度V大。) 這時候如果在圖 2.b的下方放置一堆液態水,會發生什麼情形?如圖3.a所示,圖中的分子們就是圖2.b中的分子們,有幾個就是運氣差到了一個極點,他們撞進水面時動能剛好被下方的液態水分子抵消,結果便無法反彈,最後只能停留在液態水中,換句話說,就是他們被補捉,也就是凝結了。 另一方面,液態水在水面附近的分子也正在發生相似的事:這些分子互相推擠,然後就這麼剛好,水面處有顆分子自己在往上衝的同時,又被臨近的水分子推了一把,於是他便如此這般地順勢離開水面,像個變心的女友再也回不來了(如圖3.b)。液態水分子透過這種方法逸出水面而成氣態水,就是蒸發的過程與原理,而該過程概念化的結果,則如圖3.c所示。 而圖3.a與圖3.b則分別為水的「微觀凝結」與「微觀蒸發」機制。
Fig 3. 水面補捉水分子,與水面分子逸出水面(即蒸發)。 (a) 空氣中,氣態水分子撞擊水面後無法反彈,被液態水面補捉。 (b) 液態水中,水面附近的分子互相撞擊,使少量水分子獲得能量,而逸出水面,即蒸發。 (c) 水蒸發概念圖。 以上都不是我話唬爛的,資料來源為《蒸氣壓| 科學Online – 科技部高瞻自然科學教學資源平台》: 液體靠近表面的分子,動能較大的會逃脫而進入氣態,然而逃脫分子也可能會與液體上方的氣體分子相碰撞,而使得有些分子重返液體內。密閉容器中,由液體逃脫的 分子越來越多,這些逃脫的分子也會碰撞到液體表面而被捕捉,這就出現凝結現象。 這裡講到一個重點,即從水分子的蒸發(逸出)到水分子的凝結,兩個過程中都只用水分子間的撞擊便能解釋了;而水分子撞擊的速度V來自於溫度T,因此,水分子逸出水面(蒸發)與被補捉而重回水面的速度,便只有溫度T有關,那飽和蒸氣壓E呢?蒸發、凝結,都沒用到飽和蒸氣壓E的大小啊! 所以,接下來就要進入飽和蒸氣壓E的正題了…。 在飽和蒸氣壓E的實驗中,課本(還有網路上的文章們)都是從密閉空間開始的。所以我們也來設計一個密閉空間的飽和蒸氣壓E實驗,請見圖4。
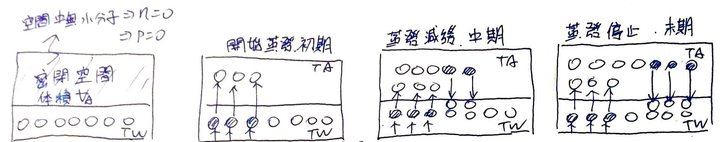
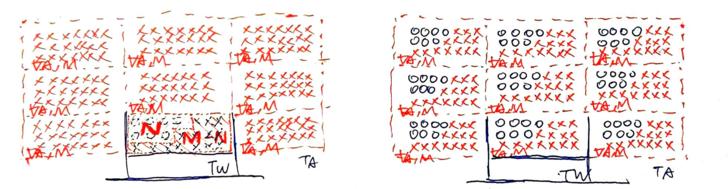
Fig 4. 密閉空間實驗:飽和水分子量 (a) 初始狀態,無擾動,無汽化核,故不沸騰,近似過熱水,只有蒸發。 (b) 密閉空間中無水分子,故只有水面的水分子大量逸出,而無補充,此時「蒸發>>凝結」。衝出水面的分子速率與水中相似,故密閉空間中開始出現溫度TA,且TA≒Tw (c) 因水溫Tw不變,故水分子逸出水面的速率不變。但上方密閉空間VA 中,氣態水分子變多了,故有小部份分子被水面補捉,只是速率沒那麼快,因此,此時「蒸發>凝結」。 (d) 水溫Tw仍不變,故水分子逸出的速率亦不變,但密閉空間VA中水分子的數量達到一個程度,使補捉率等於逸出,此時不僅蒸發與凝結同時發生,且兩者速率還相同,即「蒸發=凝結」,巨觀的蒸發處於動態平衡狀態,而密閉空間VA中的水分子數量達到飽和(N)。 圖4.a為實驗的初始狀態,我們在一個密閉的箱子裡裝了一些水,水溫為Tw,且水體的數量夠大,使蒸發的降溫可忽略(蒸發會把水體中的熱量取走,故水溫下降是正常的,但這樣一來,整個概念模型就太複雜了,所以,這裡還是就讓水溫不變吧);水上方的空間則為密閉的空間,體積為VA,初始狀態下是沒有任何氣體分子的(水分子數量n=0),即真空(密閉空間中的壓強P=0)。為了簡化實際的變數,我們將這些水設定為沒有擾動,也沒有汽化核,換言之,他們安靜又乾淨,因此即便在真空下,水也無法沸騰,有點像過熱水一樣(沸騰與過熱水請容後再述,這裡就先當作真有這回事吧…)。 實驗開始後(圖4.b),因為無法沸騰,所以實驗初期僅有水面的水分子,透過逸出而蒸發到上方的密閉空間中。同時,上方的密閉空間因為幾乎沒有氣態水分子,因此便沒有水分子可透過補捉而凝結回水體中,即「蒸發>>凝結」,故水的體積快速減少,且巨觀的蒸發率(定義為「逸出水分子量-捕捉水分子量」,或「微觀的蒸發量-凝結量」)即為水面水分子逸出的速率。此外,由於密閉空間中的水分子來自於逸出水面的水分子,故其分子速度應與其在水裡時的分子速度相似,故當密閉空間中出現水分子後,該空間中便有了溫度TA,且TA≒Tw。 到了實驗中期(圖4.c),已有一定程度的水氣分子進入密閉空間VA中了,由於實驗之設定使蒸發時的降溫不甚明顯,故此時水溫應仍保持為Tw,而前述水分子逸出水面的速度僅受水溫Tw控制,所以水分子逸出水面的速度不變。然而,密閉空間中已然容納了不少溫度亦為TA的水分子,則其凝結回水面的速率變大;即水面同時發生蒸與凝結的行為,只是凝結的速度略慢罷了。故此時巨觀的水面蒸發率(實際的蒸發 - 實際的凝結)便逐漸降低。 實驗終了後,水溫Tw不變,故水面之水分子逸出速度仍和實驗開始時相同,但因水面上方的密閉空間中塞了不少溫度TA的水分子,多到其凝結回水面的速率與逸出的速率相同。此時蒸發與凝結仍然同時發生,只是速度想同因此巨觀的蒸發率便歸零了(實際的蒸發 - 實際的凝結=0,即蒸發與凝結達到動態平衡),換句話說:此時密閉空間VA中的水分子數量已達到飽和,無法再容納更多的水分子了!(再多也只是重新凝結回去) 這些也都不是我瞎編的,資料來源為《蒸氣壓| 科學Online – 科技部高瞻自然科學教學資源平台》: 當汽化和凝結過程均以同一速率進行即平衡達成時,蒸氣中的分子數目將不會改變,此時液體呈現的蒸氣壓稱為飽和蒸氣壓,溫度越高飽和蒸氣壓越大。 只是該死的,整個過程仍是只用水分子逸出與補捉就能解釋,況且讓逸出速度增加的是水溫,而不是壓力;決定無法讓巨觀蒸發率再增加的,則是密閉空間中的水分子數量達到飽和。而這兩項因素都還是與密閉空間中的飽和蒸氣壓無關啊。 換言之,飽和蒸氣壓可能只是水分子數量飽和的結果,而不是原因、機制,因此相要飽和蒸氣壓來解釋蒸發、沸騰(飽和蒸氣壓等於大氣壓時)等現象,看起來就是拿機制的結果來討論原因,想當然爾只會走進雞生蛋、蛋生雞的無限迴圈中。 所以回過頭來,到底什麼是飽和蒸氣壓?前面說過了,在密閉空間的實驗中,讓巨觀蒸發率達到平衡的,是密閉空間中的水分子數量達到飽和了,換言之,就是密閉空間中VA的水分子數量達到水分子飽和數量N,則水體不再蒸發更水分到密閉空間中(即巨觀的蒸發停止)。 所以現在我們在密閉空間中VA中有水分子飽和數量N,其溫度則是TA(≒水溫Tw),剛好我們還有個公式叫做理想氣體方程式: P V = n R T 其中P是一團體積為V、分子數量為n的氣體,在溫度為T時的壓力,R則為常數。 我們已知的資料(V=VA, n=N, T=TA)代入理想氣體方程式可得: E VA = N R TA,則 E = (N R TA) / VA! 其中N是密閉空間VA中、溫度為TA的水分子飽和數量,此時我們已然滿足理想氣體方程式裡四個未知數(P, V, N, T)的三個,所以一定能知道密閉空間中的氣體壓強P!密閉空間中的氣體是什麼?不就是達到飽和數量的水蒸氣分子嗎,所以氣體壓強P便可稱作水蒸氣的飽和蒸氣壓E了! 因此,結論就是,在密閉空間中的飽和蒸氣壓實驗,使蒸發達到動態平衡的,是「密閉空間VA中溫度為TA的水蒸氣分子數量」達到飽和數量N,則此時密閉空間VA中所對應的氣體壓強P即為飽和蒸氣壓E,得證。 也就是說,飽和蒸氣壓E並不是拿來解釋蒸發、沸騰的工具,而是從原理解䆁蒸發後的副產品。不過這個副產品好用,因為我們不知道飽和水分子數量N到底是多少(1 mole = 6×10^23個,慢慢數吧),但幸好壓力很好測,再者,這個壓力又可以代表飽和水分子數量N,所以用飽和蒸氣壓E來代表飽和水分子數量N,何樂而不呢? 所以當一個空間VA中水氣的飽和蒸氣壓是E,從蒸發的角度來看,更應該將這個蒸氣壓E看做空間VA中可以飽和時的水分子數量標誌N,這個N值不會侷限空間中的分子數量M,因為N只是某個數量的分界。也就是說,若空間VA中水分子數量M比N小,表示空間中的水分子數量未達飽和,蒸發會持續發生,並使空間中氣態水分子數量上升到N為止;空間VA中水分子數量M比N大,則表示空間中的水分子數量已然超過飽和狀態,氣態水分子會凝結回到液態,使空間中氣態水分子數量下降到N。 綜合上述,在指定的水溫Tw下,水體有一個飽和蒸氣壓E,若上方的體積為VA的空間中,含有溫度TA與水溫Tw相同水蒸氣,則透過E、TA與VA即可換算出空間VA中的飽和水蒸氣分子數量N。這個N值(對應一個E值)是個標誌,標著空間VA中的飽和界限在哪,但無法侷限空間中的水蒸氣分子數量M。舉例來說,飽和飽和水蒸氣分子N(對應一個蒸氣壓E)就像是高速公路上的速限110公里,但有人要超速(M>N)你攔不住他,有人龜速慢行(M 所以,在瞭解了飽和蒸氣壓E的義意後,現在便能進一步來看看,如果把密閉空間的蓋子打開會發生什麼事。 為了簡化問題,我們先讓密閉空間VA中的巨觀蒸氣壓E達到平衡,也就是圖4.c中的狀態(其中TA=Tw),再將整個箱子般到真空中,然後打開蓋子…,結果應該會像圖5.a中的情況。
Fig 5. 在真空的大氣中打開密閉空間的蓋子。 (a) 大氣為真空,原本在密閉空間中的水分子跑到整個開放的空間中。 (b) 除非原本的密閉空間VA中的水分子數量達到飽和水分子數量N,否則水體的蒸發不會停止。而若要將原本的密閉空間VA中的水分子數量達到飽和水分子數量N,則在箱子外面,每個體積為VA的空間,都要容納N個水分子。 原本箱子裡的密閉空間VA裡擠了N個水分子,使該空間的水分子數量飽和。但當箱子的蓋子打開後,原本的密閉空間VA旋即成為了開放空間VA,因此水分子得以暢行無阻離開開放空間VA。同時,因外界的空間是真空的,即外界的空間裡沒有水分子,於是便不會有外界的水分子回到開放空間VA。結果就是水體的水分子不斷逸出水面並進入開放空間VA中,然後水分子又立刻逸出到外界的真空中。 上述的擴散作用使得水面上方的空間VA一直無法達到飽和狀態(空間VA中的水蒸氣分子數量M等於飽和數量N),故水體的水分子只好不停地逸出到原本的密閉空間VA中,設法讓上方的空間達到水分子的飽和數量,直到液體水全部蒸發完畢, 或是…。 或是像圖5.b那樣,逸出的水分子總算填塞了外界每個體積為VA的空間,使當中的氣態水分子數量都達到飽和水分子數量N。此時,不僅氣態水分子離開與進入開放空間VA的速率相同,且開放空間VA中的氣態水分子數量亦達到飽和數量N。如此一來,開放空間中便有足夠的氣態水分子,使水分子被補捉進入水體中(凝結)的速率,等於水體水分子逸出水面(蒸發)的速率,然後水面的巨觀蒸發便停止了。 而這個狀態,其實就等於把整個真空的大氣都視為密閉空間,而這個大空間中,每個小空間VA中都塞滿了溫度為TA、數量達到飽和分子數量N的氣態水分子,亦即大氣飽和了。 這時候,如果我們在外界中任選一塊體積等於VA的空間(如圖5.b右上角那塊),計算出裡面的水分子數量(前面提過了,是飽和數量N),透過 P VA = N R TA (TA仍然等於水溫Tw)可知,該空間中的水蒸氣壓強P即為飽和蒸氣壓E(因為N是溫度為TA的空間VA中,所能容納的最大水分子數量);又氣態水分子在整個大氣中是均勻分佈的,所以整大氣的壓強P,就是會水蒸氣的飽和蒸氣壓E。 前述這個模型是比較簡化的,因為初始假設大氣為真空。那如果一開始就把大氣中填滿空氣分子會怎樣呢(當然,不會填入水分子)
Fig 6. 在壓強為 1 atm、氣溫為 TA 的大氣中打開密閉空間的蓋子。 (a) 蓋子打開的瞬間,概念化成盒內空間VA中原有的水氣分子暫不移出,大氣分子先進入盒內,使盒內空間VA的壓強達到1 atm。此時,大氣中沒有水氣分子。 (b) 隨著水蒸氣分子由水體蒸發進空盒內空間VA,再擴散到大氣中,直到大氣都含有水分子飽和數量N之後,巨觀的大氣擴散停止,盒內空間VA的水氣分子數量終於達到飽和數量N,故水面巨觀的蒸發停止。然而,此時外界大氣的水氣分子數量亦達到飽和數量N,於是,整個大氣的含水量也飽和了。 壓強為 1 atm、氣溫為 TA 的大氣在體積為VA的空間中,可容納M個大氣分子。 根據亞佛加厥假說,壓強為 1 atm、氣溫為 TA 的大氣在體積為VA的空間中,只能容納M個氣體分子,故當體積為VA的空間中塞進N個水分子後,該空間便只能再容納M-N個大氣分子。此時氣溫為 TA 、體積為VA的空間中,水分子數量為飽和數量N,仍可計算出一個飽和蒸氣壓E,E比 1 atm 小,不足的部份由M個大氣分子補足(道爾頓分壓定律) 首先,我們把圖4.c中的箱子搬到壓強PA為 1 atm、溫度為TA = Tw 的大氣中,然後,打開蓋…等等!打開蓋子前,我們是不是應該先算一下體積為VA的空間中,若裝入了壓強為 1 atm、溫度為TA的大氣後,應該會有多少個大氣分子。 所以,幸好,根據理想氣體分程式 P V = N R T可知,一但指定了空間的體積(VA)、壓強(P)與氣體溫度(TA),那麼該空間中的大氣分子數量便是定值,所以,我們就叫這個定值為M吧。 再來這個M值,會比溫度為TA、體積為VA的飽和水分子數量N少嗎?查表可知,水的飽和蒸氣壓在溫度為攝氏0~50度時約為0.006 ~ 0.122 atm 間(都小於 1 atm),換言之,在一般的常見的室溫下(且氣溫等於水溫時),水的飽和蒸氣壓E都小於大氣壓PA。再者,一但指定了壓強(PA、E)、溫度(TA)與體積(VA)後,則體積為VA的氣態分子數量即是定值,故在沸騰前, 1 atm 的大氣分子數量M,必然會大於氣態水分子的飽和分子數量N。 其次,一個體積為VA空間,充滿了壓強為 1 atm、 溫度為TA的大氣分子,其分子數量應為M。此時,若要再空間VA中塞入N個氣態水分子,但仍要保持同樣的壓強與溫度,則此時空間VA中到底可以有幾個氣態水分子與大氣分子? 幸好亞佛加厥說了: 同溫、同壓時,同體積的任何氣體含有相同數目之分子。 因此可知,空間VA中的氣態水分子與大氣分子總和仍是M,但我們在空間VA中塞進了N個氣態水分子,故剩下的空間便只能容納 M-N 個大氣分子了。 所以現在我們可以打開蓋子了。 圖6.a顯示了打開蓋子後的情形。首先,因為打開蓋子前的密閉空間VA中只有N個溫度為TA的氣態水分子,但我們知道體積為VA的空間,應該容納M個溫度為TA、壓強為1 atm 的氣體分子。所以我們可以如此概念化:在蓋子打開的瞬間,先讓但外界溫度為TA、 1 atm 的大氣分子進入盒子中,此時盒子中VA的的空間已經裝了N個氣態水分子,所以進入盒子的大氣分子數量便只有M-N個。 之後,就如同圖5.a一樣,圖6.a中,盒子以外的空間都沒有氣態水分子,只有盒子裡的空間VA有N個,於是盒子裡的氣態水分子只好不斷地往大氣中逸出,這讓盒子裡的水分子數量從N快速向下減少,並讓水面上方空間VA中的水分子數量處於未飽和的狀態。這時水體只好使盡全力逸出氣態水分子,設法讓水面上方的氣態水分子數量重回飽和水分子數量N。但想當然爾,由於蓋子早就打開了,於是水分子數量很少的外界大氣,便會貪婪地一直取走逸出的水分子,所以水面上方空間VA中的水蒸氣分子數量一直無法達到飽和狀態,導致盒子裡的液態水必須不斷地釋出水分子到整個大氣中,直到水乾了,或是…。 是的!或是像圖6.b那樣,整個大氣中,每個體積為VA的空間裡都有N個氣態水分子;如此一來,水面上方VA的空間中的氣態水分子數量,就會保持為飽和水分子數量N個的動態平衡,然後氣態水分子被補捉回水面的速率,等於液態水分子逸出水面的速率,巨觀的蒸發便停止,盒子裡的水量也不會減少了。 然後我們再於每個體積為VA的空間中,補滿數量為M-N的大氣分子,於是大氣壓力便補回1 atm 了! 我這樣說也是有憑有據的,因為體積為VA的空間中,塞入N個溫度為TA的水分子,其壓強換算出來應該是水的飽和蒸氣壓E;然後再在VA的空間中塞入N-M個大氣分子,若令其換算出來的壓強為PA,則 E + PA = 1 atm,因為VA的空間中總共塞入了M個分子,而前面已經定義過了:一個體積為VA空間,充滿了壓強為 1 atm、 溫度為TA的大氣分子,其分子數量應為M。 這真的不是唬爛,而是道爾頓講的: 道爾頓分壓定律:在組分之間不發生化學反應的前提下,理想氣體混合物的壓強等於各組分的分壓之總和。數學描述為:Pt = P1 + P2 + P3 + …,其中 P1 、P2 、 P3、 …為每一個組分的分壓。 所以這到底是什麼意思,意思就是在我們日常生活的一大氣壓下,當溫度為TA時,如果每個體積為VA中的空間都數到N個氣態水分子,那麼我們周邊的大氣中,水分子的含量已然飽和了,於是一杯溫度為TA的水在室外放了再久,它也不會蒸發得越來越少,事實上,它的體積會保持不變,也就是說,我們的絕對溼度飽和了,或是相對溼度達到100%,端看我們愛怎麼講就怎麼講。 那水的飽和蒸氣壓E呢?老實講,解䆁水的微觀蒸發與巨觀蒸發,並不需要用到飽和蒸氣壓E這個概念,因為前面已經說過了,這完全跟水分子補捉/逸出水面的速率達到平衡有關,而水分子補捉/逸出水面的速率又僅受到溫度控制。所以,跟本就不用考量水的蒸氣壓如何影響水分子的蒸發或凝結,那講不出個所以然的。(至少我在網路上找到的說明與討論串是如此…。) 那水的飽和蒸氣壓E到底要幹麻?課本上不都這麼教?這前面也說過了,量壓強P比數分子數量N強多了,既然在指定溫度TA、體積VA的空間中,飽和水分子數量N就等於水的飽和蒸氣壓E,那麼用E去表示N,何樂而不為呢? 另外提一點,就是體積為VA的空間中,溫度為TA的飽和水分子數量N是固定的,亦即飽和蒸氣壓E是固定的,E不受外界壓力影響,只與液體溫度有關(飽和蒸氣壓僅是溫度的函數)。 ps. 見鬼了,以下的中文都是google翻譯的,我只對調了幾個中文用詞的順序與標點而已…。想當初google翻譯出來的結果是不能見人的,難怪古人說士別三日,即更刮目相待。看來google連下圍棋都能連贏六十幾位當代大師,那字母公司下一步要統治世界,恐怕也是指日可待了…。 參見:飽和蒸氣壓(saturation vapor pressure)
在給定溫度下,「物質的蒸汽」與「該物質的純液體或固相平面」互相平衡(大概是微觀蒸發速率與凝結速率相同的意思吧)時的系統蒸氣壓;即已經達到飽和,但不是過飽和的系統的蒸氣壓。
任何相對於指定母相的純物質飽和蒸氣壓,是該物質的固有性質,並且僅僅是溫度的函數。 對於水蒸汽,過冷液體上的飽和壓力,明顯不同於冰上的飽和壓力。
與平衡蒸氣壓相同。 另見:平衡蒸氣壓(saturation vapor pressure)
與蒸氣冷凝相平衡時的蒸汽壓力
這種平衡是動態的,因為蒸發和冷凝都發生,但是處於平衡。 它僅僅是溫度的函數,並且幾乎不依賴於系統中其它氣體的存在或密度。 然而,它可以取決於凝聚相的表面的形狀。 更一般地,相對於含有可溶雜質的小液滴,其平衡蒸氣壓力可能與飽和蒸汽壓力完全不同。 會提到這些,是因為在翻找資料的過程中,我發現到維基百科有段對蒸發的特性是這樣寫的: 蒸發的速度取決於多種因素: 首先,先說明一下,這段文字是在分析各項因子對「蒸發速度」的影響,而非「飽和蒸氣壓」。 其次,關於氣壓如何影蒸發速度中,其解釋是低壓施於物質表面(如液態水面)的力小,於以粒子(如液態水分子)容易逃逸(逸出水面,即微觀的蒸發),因此(巨觀的)蒸發速率較高。 如果我對這段敘述的解讀沒錯的話,即氣壓會抑制液態水分子逸出水面,那其概念模型應該如圖7所示。
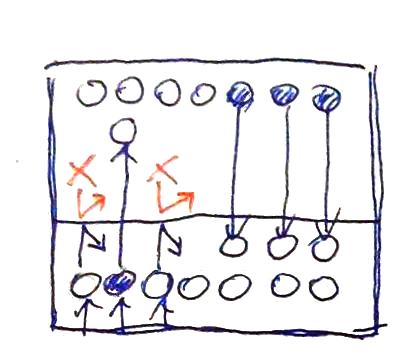
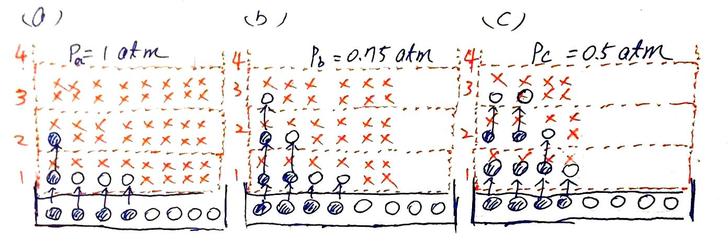
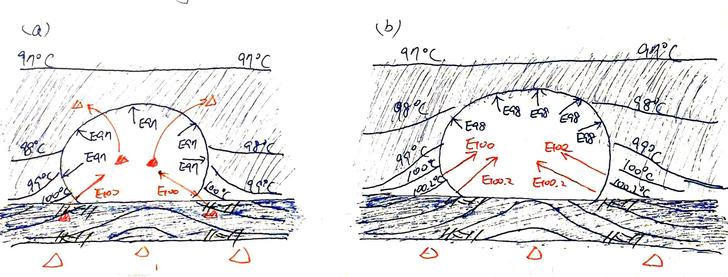
圖7. 若總壓能影響飽和蒸氣壓(分壓) 與圖4.d相較,兩個概念模型都有著水溫Tw、氣溫TA、擁有同樣密閉空間VA的密閉容器,唯一的差別在於圖7的盒子裡裝了N個氣態水分子(數量為圖4.d中的飽和水分子數量N),另其分壓為E(亦即圖4.d中的飽和蒸氣壓E),再加入大氣分子(圖7中的紅色X)使VA中的壓強達到 1 atm,圖4.d的盒子僅裝了壓強為飽和蒸氣壓E的水蒸氣)。 在圖7的概念中,大氣分子會撞擊有意要逸出水面的水分子,這個撞擊減損了水分子的動量,同時便也降低了水分子逸出水面的速率;但由於空間VA中有飽和水分子數量N(即水蒸氣的分壓為飽和蒸氣壓E),所以氣態水分子被水面補捉的速率仍不變。故一進一出的差別下,較小的逸出(微觀蒸發)速率與較大的的補捉(微觀凝結)速率,使得密閉空間VA中的氣態水分子傾向凝結回液面。意思就是,在有大氣分子的情況下,N個氣態水分子早已讓VA中的水分子數量過飽和,而VA中的水分子必須凝結回液態水中,直到VA中的氣態水分子數量減少至N’( 這與前面句「飽和蒸氣壓不受外界壓力影響」矛盾! 所以意思是什麼?意思是,如果飽和蒸氣壓不受外界壓力影響,那麼「蒸發速度受壓力的影響」顯然就不是如維基百科所述,是因為「由於施於物質表面的力較小,粒子較容易逃逸,因此蒸發速率較高」的關係所致。 那為何氣壓越低,蒸發速率會越快?如果飽和蒸氣壓不受外界壓力影響成立的話,那顯然有別的因素在支配著蒸發速率,那會是什麼呢?擴散可能才是主要的原因。 所以,首先,我們先將三杯同樣的水放到沒有水氣、但氣壓不同的大氣中,如圖8.a、圖8b與圖8.c所示(三個外界氣壓分別為 1 atm、0.75 atm 與 0.5 atm,但大氣中都沒有氣態水分子)。
圖8. 總壓不能影響飽和蒸氣壓(分壓)時,總壓對擴散與蒸發速率之影響。 (a) 氣壓為1 atm (b) 氣壓為0.75 atm (c) 氣壓為 0.5 atm。水體溫度不變,水面蒸發速率相同,但大氣中體分子數量少(壓強低),氣體擴散散率較大,故水面上的水蒸氣分子越易遠離水面,使水面上方空間內的水蒸氣分子數量M遠低於飽和分子數量N,故微觀的凝結速率減緩,在微觀的蒸發速率不變下,巨觀的蒸發速率變大。 當水杯放下去後,水面即開始蒸發出氣態水分子,而且因外界氣壓不影響飽和蒸氣壓,亦即的液態分子逸出水面的速率也不受外界氣壓所影響。如此一來,圖8中的三杯水,在單位時間中都從水面逸出了相同份量的水分子。這些逸出水面的水分子,起初都會集中在水面附近那層薄薄的空間VA(第1層)中,如此一來,跟上方那層的空間(第2層)相比,第1層中的水分子濃度顯然比第2層高太多了;於是,第1層中的水分子便開始向第2層擴散。 然而,氣態分子的擴散係數與大氣壓力成反比: 擴散係數D…隨氣體…總壓強的下降而加大。 也就是,氣壓越小,擴散係數越大,則氣體越容易擴散。於是第1層中的氣態水分子越容易擴散到上層的空間中,導致臨近水面上方空間中的氣態水分子數量越少,影響即為氣態水分子凝結回水面的速率越慢(因為沒有水分子可以回到水面)。然而,三杯水的水溫是一樣的,亦即液態水分子逸出水面的速率是一致的;所以,凝結的速越慢,水面的巨觀蒸發速率就越快。因此,氣壓越小,水的蒸發越快。 換言之,維基百科寫錯了。 好了,到此為止吧,反正我原本只是想知道飽和蒸氣壓如何決定蒸發、凝結與降雨的。 但該死的,我又看到飽和蒸氣壓等於大氣壓時水就會沸騰…,真是該死的…。 因為在查飽和蒸氣壓的過程,沸騰就像個驅不散的陰魂緊緊地在我耳邊呢喃著:當飽和蒸氣壓等於外界的大氣壓時,水就沸騰了。但我看完了每一篇網路上的文章、與互相攻詰的討論串之後,卻總覺得像霧裡看花似的,那些文字不是含糊地帶過,就是講了一堆表象,卻沒說明任何機制;要不然就是打了一大堆原理,但每個原理兜起來卻又沒個準。 例如水溫未到100度前,蒸氣氣泡裡的氣壓是蒸氣壓,因為比大氣壓小,所以氣泡被壓回去;直到水溫到達100度了,氣泡裡的蒸氣壓等於大氣壓,於是氣泡壓不住,但浮出水面,然後便沸騰了。 可是燒過水的人一定都看過,在尚未沸騰前、水溫未超過攝氏100度時,就已經有些小氣泡出現在鍋底了。重點是,這些小氣泡的體積並沒有明顯的變化,表示其內部壓強等於外部的壓強。那外部壓強有什麼?首先,氣泡與水體的交界面有表面張力,其提供了一點點的圍壓;其次,如果鍋內的水深若有10公分,我們知道10公尺的水深可提供約 1 atm 的壓強,所以水深10公分處的鍋底,又有約 0.01 atm 的水壓。第三,水面上還有 1 atm 的大氣壓。 所以加總起來,氣泡外部的壓強約有 1.01 atm (表面張力提供的壓強太少,先忽略吧),因此,在沸騰前出現在鍋底的氣泡,其內壓至少就有 1.01 atm ,根本不是蒸氣壓(約略超過攝氏100度的水才有1.01 atm),所以外壓要怎樣才能把氣泡壓回去??更何況,前面說過了,氣泡體積沒變,這只有內壓等於外壓才能發生,在這個條件下,為何又要說內壓是值較小蒸氣壓,然後被外壓是較大的大氣壓回去? 總之,網路上到處都是這類的矛盾…。 所以,沸騰又要怎麼解釋呢?首先,回到剛剛那個例子,在圖9.a中,我們在攝氏25度、氣壓為 1 atm 的大氣中點了一爐火,火上燒了一鍋水,水深10公分,而且已經燒了一段時間了,整鍋水的平均水溫少說也攝氏九十來度,這裡只說「平均」,是因為在燒水的過程中,鍋內各處的水溫度不可能相同的,基本上是上的的水溫最低,底處的水溫最高,高到可能平均下來已然接近攝氏100度。沒錯,依舊是「平均」,因為鍋底的加熱也不可能是完全均勻的,所以某些下面爐火較大的地方,水溫便能達到100度。最後鍋子表面也不是平均的,上面佈滿了大大小小的刮痕,這些地方提供了空間,使吸收了足夠能量的液態水分子能掙脫其他液態水分子間的牽絆,在刮痕處汽化成水蒸氣。然後,今天的第一顆氣泡便冒出來了。
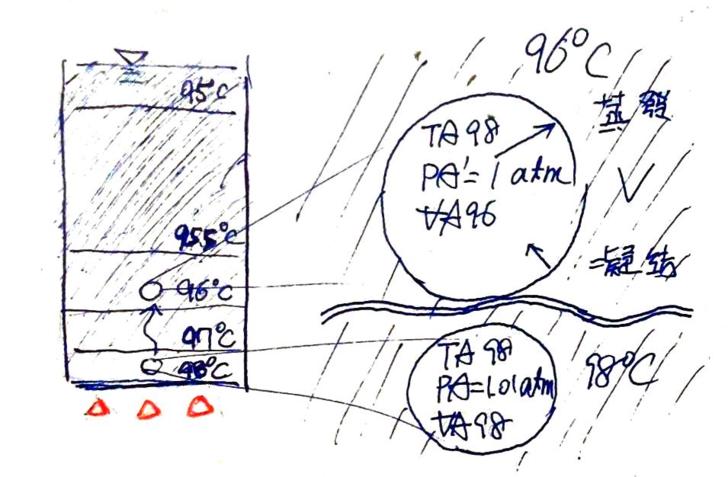
圖9. 燒水時,第一顆氣泡生成! (a) 鍋底氣泡受力來源 (b) 氣泡放大圖及其圍壓,經力平衡後可知,氣泡內的內壓應為1.01 atm(大氣壓1 atm加上水深0.1 m 時的水壓 0.01 atm)。鍋內水壓變動範圍為1.01 ~ 1 atm(鍋底到水面) (c) 水汽化後體積快速變大,故氣泡接觸到低水溫區。由於水溫不足攝氏100度,其蒸氣壓小於 1 atm,亦比氣泡的內壓小,於是氣泡內的水分子數量M高過飽和水蒸氣壓N,處於過飽和狀態,使氣泡的內水氣傾向凝結回水中,結果導致氣泡體積減少,乃至於消失。 其次,我們把那顆氣泡周邊的範圍放大,如圖9.b、圖9.c所示,此時便能釐清這顆氣泡的屬性是什麼。在壓力的部份,我們知道,如果我們丟了一團空氣到水裡,若空氣的壓強比周圍的水壓大,這團空氣所形成的氣泡便須到擴大;反之,水壓較大時,氣體體積則會縮小。放大或縮小到什麼程度?直到氣泡內壓強與外界的水壓相同時為止。在一鍋平常的自來水中,這個過程是快速的,快到氣泡才產生,體積便已然停止擴大或縮小、內部壓力與外部的壓力相同。此時氣泡體積不再變化,除非我們將氣泡內的氣態分子移走或加入,此時氣泡體才會變動(縮小或變大),但反應仍是即時的,即氣態分子數量不再改變的瞬間,無泡體積也立刻停止變化。這就像我們在吹泡泡時一樣,在吹泡泡的過程中,我們不斷地把氣態分子吹進泡泡中,於是泡泡便不斷長大;當泡泡封閉離開後,氣態分子不再進入泡泡中,泡泡便不會再變大或縮小了。 講那麼多是因為在燒水的過程中,我們會看到有些氣泡會先出現在鍋底處,並且在那邊停留一段時間。這些氣泡確實會改變體積,但那不可能是在氣泡內部分子數量固定的情況下,氣泡體積調整以平衡內外壓差的速度,因為這種速度太快了;而這些氣泡體積變化的速度,大概就和氣水杯中的氣泡的體積變化速度相似,於是這只有一種可能,那就是氣泡內的氣態分子數量出現變動,而氣泡體積便隨之調整,使氣泡內的壓強維持在與外壓相同的程度。 所以,前述說明了一個重點:在 1 atm、攝氏25度的大氣中煮開水,只要出現在鍋內的氣泡,其氣壓就會與外壓一致。外壓是多少,氣泡的內壓就會是多少,不論煮沸與否都是。 那氣泡的外壓到底是多少?把圖9.a中的那個氣泡放大成圖9.b,首先,氣泡與外界的液態水間有一層交界面,這層界面上的表面張力會提供氣泡內部一份壓強Pt;其次,氣泡在水底,故其上方與周圍的水體亦會提供一份壓強Pw;最後,這杯水放在大氣中,於是水面上的大氣再提供一份壓強P1。各項壓強的值又是多少?首先,表面強力提供的壓強比水壓與氣壓小,所以忽略不計(註1);其次,氣泡位在水面下0.1公尺處,故其壓強Pw = 0.01 atm(水下10公尺深的壓強約 1 atm),當然,氣泡頂端的水壓較小,下方的水壓最大,但因氣泡小,所以就先都當作氣泡頂端的0.01 atm好了(註1);最後,大氣壓P1,前面說過了,是 1 atm。因此,氣泡的外壓大約是1.01 atm,於是氣泡的內壓PA也是1.01 atm。(在鍋底處的內壓就是這個定值,不隨水溫而變化;氣泡浮起來時,內壓會再小一點,因為水深減少了,但再少也不會小於 1 atm,因為大氣壓就有 1 atm 了。) 值得一提的是,圖9.b中可看出,作用在氣泡上的大氣壓與水壓,其向下的分力是大於向上的分力(因為一氣泡底部一份是與鍋面相觸),這似乎就是氣泡會被壓在鍋底而不上浮的原因(把一個塑膠製的立方塊小積木放到臉盆裡,直接壓到臉盆底部的平面上,一定要彼此貼合,用力壓緊,把兩面表面間的水趕走。放手猦小積木不會浮起來,因為積木下方沒有水壓,以供向上的浮力,於是積木只會被頂端那面的向下水壓壓住,貼在臉盆底部上不來。) 那其他的參數呢?圖9.c中可看出,雖然這顆氣泡是在鍋底一個小刮㾗處發生的,且該處的局部水溫可能達到了攝氏100度。但一水撮液態水變成氣態後,其體積會膨脹不少,於是這膨脹的大氣泡會遠遠大於原本鍋底處的局部高溫範圍,繼而使自已環繞在周邊較低的水溫中。 我們知道燒水時,鍋內的水溫是向鍋頂遞減的,於是較低的水溫Tw95多少呢,就先說是攝氏95度吧。此時,氣泡的體積可量測,為VA95;溫度來自汽化的液態水,應該要是攝氏100度,但我們先說這氣泡在鍋底待了一兒,於是溫度降到與周邊的水溫一致好了(註1),那就是T95(攝氏95度);再來,外界的水溫已知,為Tw95(攝氏95度),因此可知攝氏95度時的水蒸氣壓是E95。因此根據理想氣體方程式P V = N R T可知,在體積為VA95的空間中,達到巨觀蒸發停止時的飽和水氣分子數量應為: N95 = (E95 VA95) / (R Tw95),…………(1) 為已知值。這是什麼意思?意思是,如果氣泡中的水蒸氣分子數量比N95多(或可說氣泡中的壓強大於攝氏95度時的水蒸氣壓),則氣泡中的水蒸氣分子處於過飽和狀態,微觀的凝結速率大於蒸發速率,因此巨觀的蒸發速率是負值,即水蒸氣會凝結回氣泡外的水體中;反之,若氣泡中的水蒸氣分子數量小於N95,氣泡中的水蒸氣處於未飽和狀態,水體會蒸發到氣泡中;若兩者相等,氣泡中的水蒸氣剛好飽和,巨觀的蒸發停止。 因此,關鍵在於氣泡內的空間VA95中,到底裝了多少個氣態水分子M95?先前假設好了,氣泡內氣體的溫度是TA95(等於Tw95,前面假設的),壓強PA是1.01 atm,而重點是,氣泡內的氣體分子全是由水汽化而來的,也就是說,全都是氣態的水分子!於是我們又可以透過 P V = N R T進行計算,可知氣泡內的氣態水分子數量應為: M95 = (PA VA95) / (R Tw95)。…………(2) 式1與式2可看出,VA95、T295與R是一樣的,於是氣泡內飽和水分子數量便僅由E95決定,而氣泡內的氣態水分子數量則僅由PA決定。水溫為攝氏95度時的飽和蒸氣壓E95經查表為0.8342 atm,PA則為1.01 atm,故知氣泡內的氣態水分子數量M95大於飽和水分子數量N95,即氣泡分的氣態水分子處於過飽和的態中(註2),所以水蒸氣會凝結回水面,結果就是就是我們的第一顆氣泡體積會減小。但不管如何減小,氣泡內的水分子數量仍舊會超過飽和水分子數量,於是氣泡只好不斷減少,直到消失為止。 事實上,如果仔細觀察燒開水的過程,確實可看最初出現在鍋底的氣泡會發生這種情形。不過通常大火燒水時,爐火加熱的能力,比單一顆氣泡中蒸發/凝結時的能量交換大上太多個數量級,因此鍋底只要出現氣泡,便是一個接一個地冒上來、浮出水面,看不見氣泡消失的現象。此時只要把火關掉,或是將瓦斯關到最小(爐火只剩中間那圈),這時候水溫便會慢慢冷卻下來,方才還在劇烈冒泡的地方,速度也減緩了,直到有些氣泡停留在鍋底,然後,碰!消失!(註3) (註1:忽略表面張力提供的壓強,又使用氣泡頂端較小的水壓來代替全部的水壓,只會低估氣泡的內壓PA,故實際上,氣泡內的水分子數量應該比未忽略時更多,故氣泡內的氣態水分子更容易凝結回水面。另若不假設氣泡中的溫度TA降溫至周邊的水溫Tw,則氣泡中的氣態水分子的溫度應較Tw更高,較高的溫度使氣態水分子具有較大的速度,增加撞擊而凝結回水面的速率。) (註2:由於氣泡中的水蒸氣壓強一直為1.01 atm,而整體水溫被加熱到沸騰溫度前〔比攝氏100度高一點點,就先當作是攝氏100度吧〕,其飽和蒸氣壓都不會超過1.01 atm,於是在沸騰前的每一個氣泡中其水蒸氣分子數量都處於過飽和狀態,因此巨觀來看,氣泡中的水蒸氣在沸騰前是不斷凝結回水中的。 (註3:也許有人仔細觀察過燒水的過程,然後他們會說:「不!剛冒出的泡泡不會消失!」不要擔心,我也遇過這種事,但此事先放著,最後再解釋。) 前情提要:我們的第一顆氣泡消失了。 不過,幸好,我們的爐底還在持續加熱。
圖10. 持續加熱對氣泡內部微觀蒸發與微觀凝結速率之影響 (a) 氣泡底部之鍋體升溫較快,連帶加周邊鍋體,使氣泡底部周邊的水溫上升,並向氣泡內提供蒸氣,以維持氣泡體積。同時,熱能由氣泡底部經過蒸發進入氣泡,再由上方的凝結回到水體中,有助於熱量傳遞到上層低溫水體,使水溫上升。 (b) 鍋底高溫水層厚度持續增加,更多的水蒸氣進入氣泡,使氣泡體積增加。 於是,鍋底附近的水溫Tw97被加熱到攝氏97度了(圖10.a),新形成的氣泡中,飽和水分子數量的上限抬升到比N95更大的N97,飽和上限更接近氣泡內的水蒸氣分子數量,於是凝結便減緩了。此時,我們可以看見氣泡在鍋底停留得更久,久到因為氣泡底部的鍋子沒與水接觸,而比周遭與水接處的鍋體升到更高度溫度,這樣的溫度讓氣泡底部外圍小部份的水溫升高,升高到飽和蒸氣壓E100與氣泡內的壓強PA相同,亦即該處的水溫使飽和水氣分子數量上限N100提升到與氣泡內的分子數量M100相同,此時氣泡底部周邊的水體便可以向氣泡內供應水氣分子了;當然,在氣部上半部水溫所處的飽和蒸氣壓E97仍低於氣泡內的壓強PA,故氣泡內的水蒸氣分子則仍在向水體中凝結。如果底部蒸發的速度等同於上部凝結的速度,那這個氣泡便會維持同樣的大小,而不會消失了。 而這也是我們在燒水的過程中,看到有些小氣泡停留在鍋底處,不變大也不變小的原因。 此外,由於蒸發是液態水的能量被帶離水體(蒸發時水溫降低),反過來說,凝結便是將能量由蒸氣中帶回水體。因此鍋底處的熱能傳遞路線除了經由水體的對流與傳導外,透過氣泡中的蒸發與凝結似乎也是另一種路徑,即如圖10.a中所揭示的,氣泡下緣周邊的水,當其溫度高到使飽和蒸氣壓超過氣泡內壓時,便可透過蒸發而將熱能帶進氣泡中;然而氣泡上方的水體因溫度較低,使其飽和蒸氣壓比氣泡的內壓小,於是氣泡的蒸氣便凝結回到氣泡上方的低溫水體中,連帶將熱能帶過去,進而加熱氣泡上方的低溫水體。也就是說,爐火燒水的熱能在氣泡中轉了一圈又回到水中,導至爐火的供熱,應該有大部份仍是用於加熱水體之用上,更別提還有對流所造成的熱量傳遞作用。 於是,連同水體的對流、傳導作用,鍋底附近的水溫Tw98現在被加熱到攝氏98度了(圖10.b)。 此時,這個氣泡已經在鍋底停留了一段時間,其下方與水蒸氣相觸的鍋體持續升溫,並連帶提升了周邊鍋體的溫度,然後加熱氣泡底部周遭的水體溫度。此時這些熱量一直透過蒸發而移入氣泡裡,但顯然爐火提供熱量的速度快得多。所以在僅有氣泡面蒸發的條件下,爐火提供的能量應該有辦法蓄積在氣泡底部周遭的水體中,讓小區域中的水溫略為超過沸騰溫度(令為攝氏100度),例如攝氏100.2度。此時氣泡底部的蒸發速度增加,氣泡上方周邊的水溫則因增加到攝氏98度,而令氣泡上方的凝結速率持續減少(E98比E97更接近氣泡內壓PA)。於是當氣泡下的的蒸發速率大於上方的凝結速率時,氣泡的體積便增加了。 氣泡的體積增加,浮力便上升,加上水是非線性系統,隨便一個小小的水流便能放大成渦漩,更何況鍋底還在加熱,不斷提供水流向上對流的動力。於是乎,某個渦漩掃過鍋底,然後有一顆氣泡脫離了鍋底的束縛,向上升起。
圖11. 第一顆浮起的氣泡,及上升路徑周邊水溫之遞減與其影響 這第一個浮起的氣泡,命運也可說是乖舛,因為它生成的環境是在鍋底的高溫區,若依前面的假設,其生成時的溫度TA應為攝氏98度(實際上應該要有攝氏100度,因為畢竟是由高溫水汽化而來的,但就先這麼用吧),體積可量測,故令為V98,內壓則說過了,永遠是外壓PA(1.01 atm)。但在燒水的過程中,鍋子上方的水體,因其遠離爐火、僅能靠對流增溫,故鍋子上方的水溫必然較鍋底處的水溫低,因此我們就先假設鍋子上方的水溫(Tw96)是較低的攝氏96度吧(如圖11所示)。 於是,當這顆氣泡進入較低溫的水層時會發生什麼事? 首先,氣泡的內壓與外壓相同,大氣壓 1 atm 是不變的,而氣泡在水中的深度卻變小了,在鍋底處是 0.01 atm(水深 0.1 m),往上浮的過程中會逐漸降低到 0 atm(水深 0m)。根據 P V = N R T 可知,氣泡內的水分子數量若不變,則當氣泡內的強降水減少而降低時,其氣泡的體積可能會增加,或是溫度也可能會降低(不過基本上我直覺是前者);也有可能氣泡在上升過程中,因遭遇到鍋內上層降低溫的水體而降溫。但不論體積或溫度的變化為何,可以確定的一點是,不論氣泡在0.1 m 水深中的何處,其內壓一定是在 1.01 atm與1 atm間變動(鍋底的大氣壓加深 0.1m 水壓,與水面的大氣壓)。 換言之,完全由水蒸氣所構成的氣泡,其內壓不外乎就是1.01 atm與1 atm,但鍋內的水溫由下往上遞減,使氣泡所接處的水溫不斷減少,有多少?一定比鍋底最下層的溫度小(例如圖11中的氣泡,處於攝氏96度的水體中)。低於攝氏100度的水體,例如圖11的水溫T96為攝氏96度,其飽和蒸氣壓E96必然小於 1 atm ,意味著在某一個體積的空間中(圖11中的VA96,由原本在鍋底時的VA98擴大而來)中的飽水分子數量N96,必然小於同樣體積VA96中、溫度為TA96(TA96≒Tw96,要≒TA98也是沒關係的,反正氣泡上浮後,水蒸氣分子的數量只會少,不會多)、壓強為1 atm 的氣體分子數量 M96,即氣泡內的水分子數量處於過飽和狀態,微觀的凝結速率大於蒸發速率;而且越往上走、水溫越低,這個速率差異還會越大。於是,我們第一個上升的氣泡,體積會越來越小,最後,碰!消失了。(其實原理就和前面第一個出現的氣泡一樣) 因此,當燒水時,剛開始有氣泡往上浮時,這些氣泡通常是無法到達水面的(註4)。 (註4:若火開得太大,氣泡越上浮體積越少的現象可能不好觀察,但可以把火關小,自然就能看到氣泡在上浮的過程中消失了。然後,隨著鍋底的冷卻,氣泡出現的速率越來越少,直到僅停留上鍋底上而不上浮,最後,這些氣泡也會消失不見。) 當然,氣泡雖然消失了,但我覺得它終究還是有貢獻的,畢竟,在燒水的過程中,僅能靠對流作用將鍋底的熱能向上方傳送。然而,當水蒸氣氣泡開始脫離鍋底向上飄浮後,連帶著將周遭的高溫水流一起向上方帶,加速了鍋底熱能往上傳送的速度。 於是,越多的氣泡向上浮(雖然多數在到達水面前便壯烈成仁……凝結回水中了),使得鍋底上、下的溫差快速減少,整體的水溫越來越多,氣泡內部的水蒸氣在上升時越不易凝結回水體, 故終將有第一顆氣泡自水面冒出頭,然後是第二顆、第三顆、第千千萬萬顆。這些快速產生又浮水面的氣泡,使水流擾動的範圍達到整個水體,於是水溫分佈被攪得比早前更均勻。最後,整鍋水的水溫便能在短時間達到攝氏100度。
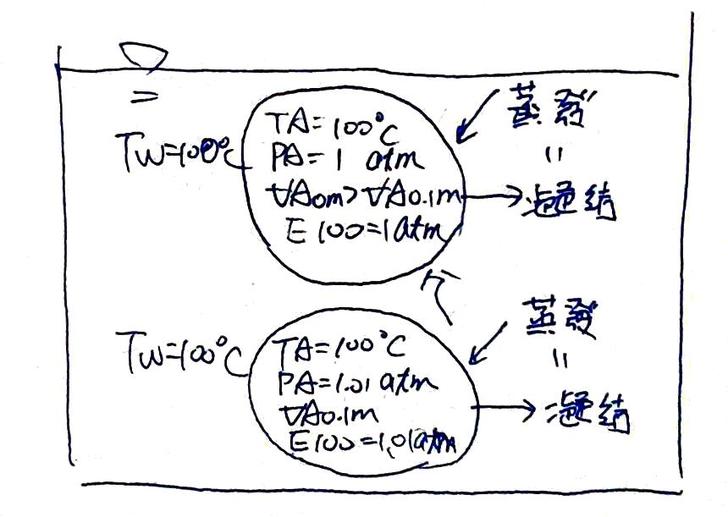
圖12. 完全沸騰 當整鍋水都均勻地達到攝氏100度後(如圖12),整鍋水各部份水體的飽和蒸氣壓都達到 1 atm,可知若溫度為攝氏100度的水蒸氣在水體中佔據了一處體積為VA的空間,其飽和水分子數量應為N100。然而蒸氣氣泡裡的內壓也是 1 atm,故實際存在於氣泡內的分子數量M100會等於飽和水分子數量N100,亦即此時氣泡內水分子的微觀蒸發與凝結速率相等,所以巨觀的水分子凝結停止。故水體中任一處出現一顆氣泡,這顆氣泡便不會再消失,只會毫無保留、義無反顧地衝出水面,於是,水就沸騰了。 而這也是我們說「當飽和蒸氣壓等於大氣壓時,水會沸騰」的原理。 最後,總結一下: 1. 飽和蒸氣壓E僅與溫度T有關,在意義上更像個標誌,標示著在指定體積為V的空間中的飽和水分子數量N。 2. 體積為V的空間中,可塞入任意個溫度為T的水蒸氣分子;但若塞入水蒸氣分子數量M超過飽和水分子數量N,則氣態水分子傾向凝結成液態;數量M不足N,則液態水分子傾向蒸發成氣態;M與N相同,則蒸發與凝結達到動態平衡。 3. 在已知溫度T與體積V的空間中,M個水蒸氣分子可求其形成之壓強P。在已知溫度T與體積V的空間中,飽和水分子數量N亦可換算成壓強,定義為在溫度T時的飽和蒸壓E。 4. 由上述故可知,在已知溫度T與體積V的空間中,若僅有水蒸氣分子,其構築的壓強P>E ,水蒸氣分子處於過飽和狀態,氣態水分子傾向凝結成液態;P 5. 水沸騰前(飽和蒸氣壓 ≡ 1atm),在水中產生的氣泡完全由水蒸氣組成,不限位置與溫度,其壓強必為外壓,量值為大氣壓加水壓。且因為尚未沸騰,水體中多數位置的飽和蒸氣壓皆小於 1 atm, 6. 水沸騰前(飽和蒸氣壓 ≡ 1 atm),氣泡除了在非常接近鍋底的水體外,其他位置的飽和蒸氣壓E都小於 1 atm ,亦小於氣泡的內壓P,因此氣泡中的水蒸氣分子數量M皆大於飽和水分子數量N,故氣泡中的氣態水蒸氣傾向凝結回液態水,使氣泡變小,即便是已在上升的氣泡仍是如此。 7. 氣泡的存在有助於熱量由水的底部往上方傳遞,若氣泡浮起,其帶動的水流更可將可觀的熱量帶至水面,使整體水溫之分佈更平均。 8. 當整體水溫達到飽和蒸氣壓E為 1atm(約攝氏100度),飽和蒸氣壓E與氣泡內的壓強P相同,意味著氣泡內的氣態水分子數量M等於飽和水分子數量N,於是蒸發與凝結速率達到動態平衡,氣泡便不再變小,除了可直接上浮至水面,其體積亦因壓力降低(上浮後水深減少,故水壓降低)而變大。 9. 於是水就沸騰了。 為了證明上述的想法是正確的,我還特定為此去燒了一鍋水,結果,該死的,怎麼不是我想像中的那個樣子!!真的,相信我,有空的人自己也去煮一鍋水,就會發現早在水溫上升到九十幾度前,鍋底便出現了許多小小的氣泡,約末這個句點「○」那麼大。我沒有工具可以量溫度,但我相信此時的溫度僅有攝氏八、九十度出頭,因為大量上浮的氣泡還要很久之後才會出現。而且更糟的是,這些氣泡不會消失,還越來越多,遍佈整個鍋底,然後開始合併成大氣泡,然後開始上浮,然後從來沒有消失!一個也沒有!即便關掉火也是,氣泡只是停止出現,但即便等了很久,水溫降下來後也不會消失!為此我還把這鍋水泡到更大的桶子裡,結果還是一樣! 這個問題消耗了我整個晚上的時間,還有一大堆瓦斯,然後當某一刻,我將這鍋終於煮沸的水冷卻再加熱後,突然發現剛才那些小氣泡不見了! 所以,原來是有什麼東西在水裡,加熱後跑出來變成氣泡,整鍋水沸騰後跟著大量的氣泡一同逸到空氣中。待水冷卻後,那東西早已消失了,於是重新加熱後,便不會再出現這些意料之外的氣泡! 所以,那東西會是什麼,我想,最有可能是消毒用的氯氣了。於是我上網查了一下: 自來水在淨水場加氯氯消毒過程中,水中有機物和氯反應會形成三鹵甲烷,其主要生成物包括氯仿(註:即三氯甲烷)、一溴二氯甲烷、二溴一氯甲烷、溴仿等四者合稱三鹵甲烷。——高雄市政府環境保護局 又: (本研究)全面檢測各縣市自來水之消毒副產物三鹵甲烷…,三鹵甲烷組成份以三氯甲烷濃度佔57.5 %最高,三溴甲烷5.0 %最低。——自來水三鹵甲烷含量之調查研究 三氯甲烷就是氯仿,氯仿的沸點為攝氏61.15度,即在攝氏61.15度時,氯仿的飽和蒸氣壓為1 atm ! 所以在燒水時,水溫一但超過攝氏61.15度後,水中含有的氯仿便會開始汽化成氣態,且因鍋底處的水溫最高,故氯仿氣泡便是由鍋底處開始出現的。然而水中的氯仿含量不高,於是無法快速形成更大的氣泡,而因體積有限,氣泡便無法上浮,故只會停留在溫度逐漸升高的鍋底處。 此時,氯仿氣泡內的壓強P為1 atm,但由於水溫T早已超過攝氏61.15度,因此,怎氯仿的飽和蒸氣壓E便會超過 1 atm,意即氣泡內的氯仿分子數量M低於飽和分子數量N,所以水中的氯仿會持續地蒸發到氣泡中!所以氣泡不會消失!所以還會慢慢長大!而當氣泡大到終於可以浮起時,整鍋水的水溫早已超過攝氏61.15度,因此氣泡在上升的過程中,也不會將氯仿凝結回水中,因此氣泡便能上升到上面上了!最後,由於氯仿氣泡出現時,水溫已然超過攝氏61.15度,因此即便此刻將爐火關掉,但氣泡周邊的水溫仍要一段時間才能降低,於是,氣泡便會一直杵在鍋底不肯消失! 結論:這些最早出現的氣泡不是水蒸氣,而是氯仿蒸氣(連同其他一堆三鹵甲烷的分子),它們不是純水沸騰過程中該出現的東西! 幸好我們可以移除它們,先把水燒開了,讓這些雜質逸出,然後再降溫重燒一次,這回就看到水沸騰的真正過程了。 還有,阿門,這回沸騰現象就和我當初想像中的一模一樣了。 最後,突沸就簡單了。當裝水的杯子光滑無瑕疵(如玻璃杯),杯中的水沒有雜質,連多餘的擾動也沒有。此時,水中沒有汽化核,氣泡無法出現,於是熱源供給到水中的能量,便只能透過傳導與水面蒸發這兩種路徑,將熱量由杯子向外界傳遞。所以供熱功率很容易超過水體的散熱功率,故水體便可被加熱超過攝氏100度。此時,只要在過熱的水中加入一些汽化核,如咖啡粉、湯匙等雜質,甚至只是攪動時帶進的氣泡,水蒸氣氣泡便會依附著這些汽化核產生。 然而,因水溫早已起過攝氏100度,即氣泡中的飽和蒸氣壓E超過 1 atm。但氣泡內的壓強僅等於外壓的 1 atm,表示著氣泡內的水蒸氣分子數量M低於飽和分子數量N,故水體會快速地將水分子蒸發到氣泡中,令每個氣泡快速地增大體積。由於一次加入了很多的汽化核,每個汽化核會產生很多氣泡,每個氣泡又快速加大體積,於是杯內突然出現大量上升的氣泡,連同沸水一同衝出杯口,突沸便發生了。 |
|
| ( 知識學習|科學百科 ) |